UP Board Solutions for Class 11 Chemistry Chapter 3 Classification of Elements and Periodicity in Properties (तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता)
UP Board Solutions for Class 11 Chemistry Chapter 3 Classification of Elements and Periodicity in Properties (तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता)
पाठ के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
आवर्त सारणी में व्यवस्था का भौतिक आधार क्या है?
उत्तर
आवर्त सारणी में व्यवस्था का भौतिक आधार समान गुणधर्म (भौतिक तथा रासायनिक गुण) वाले तत्वों को एकसाथ एक ही वर्ग में रखना है। चूंकि तत्वों के ये गुणधर्म मुख्यत: उनके संयोजी कोश के इलेक्ट्रॉनिक विन्यास पर निर्भर करते हैं। अत: किसी समूह के तत्वों के परमाणुओं के संयोजी कोश विन्यास समान होते हैं।
प्रश्न 2.
मेंडलीव ने किस महत्त्वपूर्ण गुणधर्म को अपनी आवर्त सारणी में तत्वों के वर्गीकरण का आधार बनाया? क्या वे उस पर दृढ़ रह पाए?
उत्तर
मेंडलीव ने परमाणु भार को, तत्त्वों के वर्गीकरण का आधार माना तथा तत्त्वों को बढ़ते हुए परमाणु भार के क्रम में व्यवस्थित किया। वह अपने आधार पर निष्ठापूर्वक दृढ़ रहे तथा उन्होंने उन तत्त्वों के लिए रिक्त स्थान छोड़ा जो उस समय ज्ञात नहीं थे तथा उनके परमाणु भारों के आधार पर, उनके लक्षणों या गुणों की भविष्यवाणी की। उनकी भविष्यवाणियाँ उन तत्त्वों की खोज होने पर सत्य पायी गयीं।
प्रश्न 3.
मेंडलीव के आवर्त नियम और आधुनिक आवर्त नियम में मौलिक अन्तर क्या है?
उत्तर
मेंडलीव का आवर्त नियम तत्त्वों के परमाणु भारों पर आधारित है, जबकि आधुनिक आवर्त नियम तत्त्वों के परमाणु क्रमांकों पर आधारित है। इस प्रकार मौलिक अन्तर वर्गीकरण का आधार है।
प्रश्न 4.
क्वाण्टम संख्याओं के आधार पर यह सिद्ध कीजिए कि आवर्त सारणी के छठवें आवर्त में 32 तत्व होने चाहिए।
उत्तर
आवर्त सारणी के दीर्घ रूप में प्रत्येक आवर्त एक नई कक्षा के भरने से प्रारम्भ होता है। छठवाँ आवर्त (मुख्य क्वाण्टम संख्या = 6)n = 6 से प्रारम्भ होता है। इस कक्ष के लिए, n= 6 तथा != 0,1, 2 तथा 3 होगा (उच्च मान आदेशित नहीं है)।
इस प्रकार, उपकक्षाएँ 6s, 6p, 6d तथा 6 इलेक्ट्रॉनों के समावेशन के लिए उपलब्ध हैं। किन्तु आँफबाऊ के नियमानुसार 6d तथा 6/-उपकक्षाओं की ऊर्जा 7s-उपकक्षाओं की तुलना में अधिक होती है। इसलिए यह कक्षाएँ 7s उपकक्षाओं के भरने तक नहीं भरती हैं। इसके अतिरिक्त 5d- तथा 4- उपकक्षाओं की ऊर्जाएँ 6p- उपकक्षाओं से कम होती हैं। इसलिए, छठवें आवर्त में, इलेक्ट्रॉन्स केवल 6s, 4,5d तथा 6p- उपकक्षाओं में भरते हैं। इन उपकक्षाओं में इलेक्ट्रॉन्स की संख्याएँ क्रमशः 2, 14, 10 तथा 6 होती हैं अर्थात् कुल 32 इलेक्ट्रॉन्स होते हैं। इसी कारण छठवें आवर्त में 32 तत्त्व होते।
प्रश्न 5.
आवर्त और वर्ग के पदों में यह बताइए कि z = 14 कहाँ स्थित होगा?
उत्तर
z=114 तत्त्व का इलेक्ट्रॉनिक विन्यास निम्न है-

![]()
यह स्पष्ट है कि दिया तत्त्व एक सामान्य तत्त्व है तथा आवर्त सारणी के p-ब्लॉक से सम्बन्धित है।’ चूँकि इस तत्त्व में n = 7 कक्ष में इलेक्ट्रॉन उपस्थित हैं, अत: यह आवर्त सारणी के सातवें आवर्त में स्थित होगा। इसके अतिरिक्त समूह की संख्या = 10+ संयोजी इलेक्ट्रॉनों की संख्या
= 10 +4 = 14
अतः दिया गया तत्त्व सातवें आवर्त में तथा समूह 14 में स्थित है।
प्रश्न 6.
उस तत्व का परमाणु क्रमांक लिखिए, जो आवर्त सारणी में तीसरे आवर्त और 17वें वर्ग में स्थित होता है।
उत्तर
तीसरे आवर्त में केवल 3- तथा 3p-कक्षाएँ भरती हैं। अत: आवर्त में केवल दो – तथा छः p-ब्लॉक के तत्त्व होते हैं। तीसरा आवर्त Z=11 से प्रारम्भ होकर Z= 18 पर समाप्त होता है। अतः Z=11 तथा Z= 12 के तत्त्व -ब्लॉक में स्थित होंगे। अगले छः तत्त्व Z = 13 (समूह 13) से Z= 18 (समूह 18)p-ब्लॉक के तत्त्व हैं। इसलिए वह तत्त्व जो 17वें समूह में स्थित है उसका परमाणु क्रमांक Z = 17 होगा।
प्रश्न 7.
कौन-से तत्व का नाम निम्नलिखित द्वारा दिया गया है?
(i) लॉरेन्स बर्कले प्रयोगशाला द्वारा
(ii) सी बोर्ग समूह द्वारा।
उत्तर
- लॉरेन्सियम (Lawrencium) (Z=103) तथा बर्केलियम (Berkelium) (Z=97)
- सीबोर्गीयम (Seaborgium) (Z = 106)
प्रश्न 8.
एक ही वर्ग में उपस्थित तत्वों के भौतिक और रासायनिक गुणधर्म समान क्यों होते हैं?
उत्तर
एक ही वर्ग में उपस्थित तत्त्वों के इलेक्ट्रॉनिक विन्यास समान होते हैं अर्थात् उनकी संयोजी कक्षा में इलेक्ट्रॉनों की संख्या समान होती है। इसी कारण से एक ही वर्ग में उपस्थित तत्त्वों के भौतिक तथा रासायनिक गुणधर्म समान होते हैं।
प्रश्न 9.
परमाणु त्रिज्या’ और ‘आयनिक त्रिज्या से आप क्या समझते हैं?
उत्तर
परमाणु त्रिज्या से तात्पर्य परमाणु का आकार है, जो परमाणु के नाभिक के केन्द्र से बाह्यतम कक्षा के इलेक्ट्रॉन की दूरी के बराबर मानी जाती है। किसी आयन की ‘आयनिक त्रिज्या’ उसके नाभिक तथा उस बिन्दु के मध्य की दूरी को माना जाता है जिस पर नाभिक का प्रभाव आयन के इलेक्ट्रॉन मेघ पर प्रभावी होता है।
प्रश्न 10.
किसी वर्ग या आवर्त में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है? इस परिवर्तन की व्याख्या आप किस प्रकार करेंगे?
उत्तर
आवर्त में परमाणु त्रिज्याएँ (Atomic Radii in Periods) किसी आवर्त में बाएँ से दाएँ चलने पर परमाणु त्रिज्याएँ नियमित क्रम में क्षार धातु से हैलोजेन तक घटती हैं; क्योंकि नाभिकीय आवेश बढ़ने के साथ-साथ बाह्यतम कोश के इलेक्ट्रॉनों की संख्या भी बढ़ती है, फलस्वरूप बाह्यतम कोश के इलेक्ट्रॉनों को आकर्षित करने की क्षमता भी बढ़ती है। इस कारण इनकी नाभिक व बाह्यतमं कोशों के बीच की दूरी क्रमशः घटती है; अत: परमाणु त्रिज्या घटती है। (यह ध्यान देने योग्य है कि यहाँ उत्कृष्ट गैसों की परमाणु त्रिज्या पर विचार नहीं किया जा रहा है। एकल परमाणु होने के कारण उनकी आबन्धित त्रिज्या बहुत अधिक है। इसलिए उत्कृष्ट गैसों की तुलना दूसरे तत्वों की सहसंयोजक त्रिज्या से न करके वाण्डरवाल्स त्रिज्या से करते हैं।)
कुछ तत्वों के लिए परमाणु त्रिज्या का मान निम्नांकित सारणी-1 में दिया गया है-
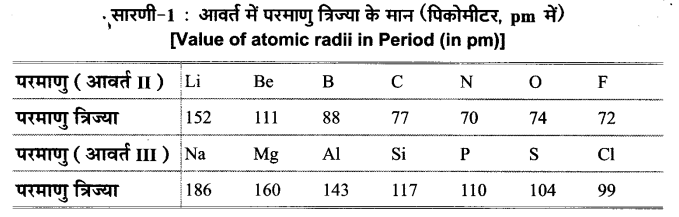
द्वितीय आवर्त में परमाणु त्रिज्या में परमाणु क्रमांक के साथ परिवर्तन चित्र-1 में प्रदर्शित वक्र द्वारा और अधिक स्पष्ट होता है। वक्र में स्पष्ट प्रदर्शित है कि नितान्त बाईं ओर स्थित क्षार धातु (Li) की परमाणु त्रिज्या अधिकतम तथा नितान्त दाईं ओर स्थित हैलोजेन (F) की परमाणु त्रिज्या का मान न्यूनतम है।

वर्ग में परमाणु त्रिज्याएँ (Atomic radii in Groups)
किसी वर्ग में ऊपर से नीचे चलने पर परमाणु त्रिज्याएँ बढ़ती हैं; क्योंकि जैसे-जैसे नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉनिक कोशों की संख्या बढ़ती जाती है, फलस्वरूप बाह्यतम कोश के इलेक्ट्रॉनों को आकर्षित करने की क्षमता घटती है; अत: परमाणु त्रिज्या बढ़ती है।
निम्नांकित सारणी-2 में धातुओं तथा हैलोजेन तत्वों के लिए परमाणु त्रिज्याएँ दी गई हैं


वर्ग में परमाणु क्रमांकों के साथ क्षार धातुओं तथा हैलोजेनों की परमाणु त्रिज्याओं में परिवर्तन चित्र-2 में प्रदर्शित वक्र द्वारा और अधिक स्पष्ट होता है। मानों से यह स्पष्ट है कि लीथियम (Li) की परमाणु त्रिज्या न्यूनतम तथा सीजियम (Cs) की अधिकतम है। इसी प्रकार हैलोजेनों में फ्लुओरीन (F) की परमाणु त्रिज्या न्यूनतम तथा आयोडीन (I) की अधिकतम है।

प्रश्न 11.
समइलेक्ट्रॉनिक स्पीशीज से आप क्या समझते हैं? एक ऐसी स्पीशीज का नाम लिखिए, जो निम्नलिखित परमाणुओं या आयनों के साथ समइलेक्ट्रॉनिक होगी-
(i) F
(ii) Ar
(iii) Mg2+
(iv) Rb+
उत्तर
वे स्पीशीज (विभिन्न तत्त्वों के आयन या परमाणु) जिनमें इलेक्ट्रॉनों की संख्या समने होती है। लेकिन नाभिकीय आवेश भिन्न होता है, समइलेक्ट्रॉनिक स्पीशीज कहलाती हैं।

प्रश्न 12.
निम्नलिखित स्पीशीज पर विचार कीजिए- –
N3-,O2-, F–, Na+, Mg2+ तथा Al3+
(क) इनमें क्या समानता है? |
(ख) इन्हें आयनिक त्रिज्या के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर
(क) दी गई प्रत्येक स्पीशीज में 10 इलेक्ट्रॉन हैं। अत: ये सब समइलेक्ट्रॉनिक स्पीशीज हैं।
(ख) समइलेक्ट्रॉनिक आयनों की आयनिक त्रिज्या, परमाणु आवेश के बढ़ने के साथ घटती है। दी।

प्रश्न 13.
धनायन अपने जनक परमाणुओं से छोटे क्यों होते हैं और ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक क्यों होती है? व्याख्या कीजिए।
उत्तर
जनक परमाणुओं से एक या अधिक इलेक्ट्रॉनों के निकलने पर प्रभावी नाभिकीय आवेश बढ़ता है। इस प्रकार बचे हुए इलेक्ट्रॉन अधिक नाभिकीय आकर्षण का अनुभव करते हैं। परिणामस्वरूप त्रिज्या घटती है। इसी कारण धनायन की त्रिज्या उनके जनक परमाणु से छोटी होती है। दूसरी ओर, जनके परमाणुओं में एक या अधिक इलेक्ट्रॉन बढ़ने पर प्रभावी नाभिकीय आवेश घटता है। इस प्रकार, इलेक्ट्रॉन कम नाभिकीय आकर्षण या खिंचाव अनुभव करते हैं। परिणामस्वरूप त्रिज्या बढ़ती है। इसी कारण से ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक होती है।
प्रश्न 14.
आयनन एन्थैल्पी और इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करने में विलगित गैसीय परमाणु तथा ‘आद्य अवस्था पदों की सार्थकता क्या है?
उत्तर
किसी परमाणु के नाभिक द्वारा उसमें उपस्थित इलेक्ट्रॉनों पर आरोपित बल काफी मात्रा में अणु में उपस्थित अन्य परमाणुओं तथा पड़ौसी परमाणुओं की उपस्थिति पर निर्भर करता है। चूंकि इस बल का परिमाण आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी के मानों को निर्धारित करता है, अतः इन्हें विलगित परमाणुओं के लिए परिभाषित करना आवश्यक है। एक अकेले परमाणु को विलगित करना सम्भव नहीं है। चूंकि गैसीय अवस्था में परमाणु (या अणु) काफी अलग होते हैं, आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी गैसीय परमाणुओं के लिए परिभाषित की जाती है तथा यह माना जाता है कि वे विलगित हैं। इसके अतिरिक्त आद्य अवस्था (ground state) निम्नतम ऊर्जा की अवस्था अर्थात् सबसे अधिक स्थाई अवस्था को निर्देशित करती है। यदि परमाणु उत्तेजित अवस्था में है, तो इसकी ऊर्जा का एक निश्चित मान होगा और इस अवस्था में आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी के मान भिन्न होंगे। अतः आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करते समय एक गैसीय परमाणु को आद्य अवस्था में स्थित होना आवश्यक है।
प्रश्न 15.
हाइड्रोजन परमाणु में आद्य अवस्था में इलेक्ट्रॉन की ऊर्जा -2.18 x 10-18 J है। परमाणविक हाइड्रोजन की आयनन एन्थैल्पी Jmol-1 के पदों में परिकलित कीजिए।
उत्तर
हाइड्रोजन परमाणु की आद्य अवस्था से इलेक्ट्रॉन निकालने के लिए आवश्यक ऊर्जा

प्रश्न 16.
द्वितीय आवर्त के तत्वों में वास्तविक आयनन एन्थैल्पी का क्रम इस प्रकार है
Li< B < Be<C< O< N < F < Ne व्याख्या कीजिए कि
(i) Be की ∆i,H, B से अधिक क्यों है?
(ii) O की ∆iH, N और F से कम क्यों है?
उत्तर
(i) Be तथा B के इलेक्ट्रॉनिक विन्यास निम्नांकित प्रकार हैं
4Be= 2,2 या 1s2 ,2s2
5B= 2, 3 या 1s2 ,2s2 2p1
बोरॉन (B) में, इसके एक 2p कक्षक में एक अयुग्मित इलेक्ट्रॉन है। बेरिलियम (Be) में युग्मित : इलेक्ट्रॉनों वाले पूर्ण-पूरित ls तथा 25 कक्षक हैं।
जब हम एक ही मुख्य क्वाण्टम ऊर्जा स्तर पर विचार करते हैं तो 5-इलेक्ट्रॉन p-इलेक्ट्रॉन की तुलना में नाभिक की ओर अधिक आकर्षित होता है। बेरिलियम में बाह्यतम इलेक्ट्रॉन, जो अलग किया जाएगा, वह 5-इलेक्ट्रॉन होगा, जबकि बोरॉन में बाह्यतम इलेक्ट्रॉन (जो अलग किया जाएगा) p-इलेक्ट्रॉन होगा। उल्लेखनीय है कि नाभिक की ओर 2-इलेक्ट्रॉन का भेदन (penetration) 2p-इलेक्ट्रॉन की तुलना में अधिक होता है। इस प्रकार बोरॉन का 2p-इलेक्ट्रॉन बेरिलियम के 2-इलेक्ट्रॉन की तुलना में आन्तरिक क्रोड इलेक्ट्रॉनों द्वारा अधिक परिरक्षित होता है। चूंकि बेरिलियम के 25-इलेक्ट्रॉन की तुलना में बोरॉन को 2p-इलेक्ट्रॉन अधिक सरलता से पृथक् हो जाता है; अत: बेरिलियम की तुलना में बोरॉन की प्रथम आयनन एन्थैल्पी (∆iH) का मान कम होगा।
(ii) नाइट्रोजन तथा ऑक्सीजन के इलेक्ट्रॉनिक विन्यास निम्नांकित प्रकार हैं
7N = 2,5 या 1s2, 2s2 2p1x 2p1y 2p1z
8O= 2,6 या 1s2 , 2s2 2p2x 2p1y 2p1z
स्पष्ट है कि नाइट्रोजन में तीनों बाह्यतम 2p-इलेक्ट्रॉन विभिन्न p-कक्षकों में वितरित हैं (हुण्ड का नियम), जबकि ऑक्सीजन के चारों 2p-इलेक्ट्रॉनों में से दो 2p-इलेक्ट्रॉन एक ही 2p-ऑर्बिटल में हैं; फलतः इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। फलस्वरूप नाइट्रोजन के तीनों 2p-इलेक्ट्रॉनों में से एक इलेक्ट्रॉन पृथक् करने की तुलना में ऑक्सीजन के चारों 2p-इलेक्ट्रॉनों में से चौथे इलेक्ट्रॉन को पृथक् करना सरल हो जाता है; अतः 6 की प्रथम आयनन एन्थैल्पी (∆iH) का मान N से कम होता है। यही स्पष्टीकरण F के लिए भी दिया जा सकता है।
प्रश्न 17.
आप इस तथ्य की व्याख्या किस प्रकार करेंगे कि सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की प्रथम आयनन एन्थैल्पी से कम है, किन्तु इसकी द्वितीय आयनन एन्थैल्पी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक है?
उत्तर
Na तथा Mg के इलेक्ट्रॉनिक विन्यास निम्न हैं-
Na (Z= 11): 1s2 2s2 2p6 3s1
Mg (Z= 12): 1s2 2s2 2p6 3s2
चूँकि सोडियम (+11) ; में मैग्नीशियम’ (+12) की तुलना में कम नाभिकीय आवेश है, सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की तुलना में कम होगी।
प्रथम इलेक्ट्रॉन निकलने के बाद, सोडियम Na+ आयन में परिवर्तित हो जाता है तथा मैग्नीशियम Mg+ में। इनका इलेक्ट्रॉनिक विन्यास निम्न प्रकार से होगा-
Na+ : 1s2 2s2 2p6
Mg+ : 1s2 2s2 2p6 3s1
Na+ आयन का इलेक्ट्रॉनिक विन्यास निऑन के समान एक बहुत अधिक स्थाई इलेक्ट्रॉनिक विन्यास , है। इसलिए Na+ आयन से Mg की तुलना में इलेक्ट्रॉन निकालने के लिए अधिक ऊर्जा की आवश्यकता होगी। इसी कारण से सोडियम की द्वितीय आयनन एन्थैल्पी, मैग्नीशियम की तुलना में अधिक होती है।
प्रश्न 18.
मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के कौन-से कारक हैं?
उत्तर
मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के विभिन्न कारक निम्नलिखित हैं-
- समूह में नीचे जाने पर नाभिकीय आवेश बढ़ता है।
- समूह में नीचे जाने पर प्रत्येक तत्व में नए कोश जुड़ जाने के कारण परमाणु आकार बढ़ जाते ।
- समूह में नीचे जाने पर आन्तरिक इलेक्ट्रॉनों की संख्या बढ़ जाती है। इससे बाह्यतम इलेक्ट्रॉनों पर आवरण-प्रभाव घट जाता है।
परमाणु आकार में वृद्धि तथा आवरण-प्रभाव का संयुक्त प्रभाव नाभिकीय आवेश में वृद्धि के प्रभाव से अधिक हो जाता है। ये प्रभाव इस प्रकार कार्य करते हैं कि नाभिक तथा बाह्यतम इलेक्ट्रॉनों के मध्य आकर्षण बल कम हो जाता है। परिणामस्वरूप समूह में नीचे जाने पर आयनन एन्थैल्पी कम हो जाती है।
प्रश्न 19.
वर्ग 13 के तत्वों की प्रथम आयनन एन्थैल्पी के मान (kJ mol-1) में इस प्रकार हैं-

उत्तर
सामान्य परम्परा के अनुसार वर्ग 13 में ऊपर से नीचे जाने पर आयनन एन्थैल्पी घटती है। लेकिन Ga तथा TI इसके अपवाद हैं। d तथा / इलेक्ट्रॉनों का परिरक्षण प्रभाव (shielding effect) 5 तथा 2 इलेक्ट्रॉनों की तुलना में कम होता है। Ga में 3d इलेक्ट्रॉन होते हैं, जबकि T1 में 5d तथा 47 इलेक्ट्रॉन होते हैं। कम परिरक्षण प्रभाव के कारण, Ga तथा T1 परमाणुओं के नाभिक संयोजी इलेक्ट्रॉन को मजबूती से बाँधे रखते हैं। इसी कारण से पड़ौसी तत्त्वों की तुलना में इनकी आयनन एन्थैल्पी अधिक होती है।
प्रश्न 20.
तत्वों के निम्नलिखित युग्मों में किस तत्व की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी?
(i) O या F
(ii) F या Cl
उत्तर
- F की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी। O से F तक जाने में, परमाणु आकार घटता है तथा नाभिकीय आवेश बढ़ता है। ये दोनों कारक फ्लुओरीन की इलेक्ट्रॉन लब्धि एन्थैल्पी के मान को अधिक ऋणात्मक बनाते हैं क्योंकि ये आने वाले इलेक्ट्रॉन के लिए नाभिकीय आकर्षण में वृद्धि करते हैं।
- CI की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होती है।
प्रश्न 21.
आप क्या सोचते हैं कि O की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी के समान धनात्मक, अधिक ऋणात्मक या कम ऋणात्मक होगी? अपने उत्तर की पुष्टि कीजिए।
उत्तर
ऑक्सीजन (O) की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है। उदासीन ऑक्सीजन परमाणु में प्रथम इलेक्ट्रॉन के जुड़ने पर ऊर्जा का निष्कासन होता है तथा प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक होती है।
O(g)+e– → O– (g); ∆eg H= -141.0 kJ
और अधिक इलेक्ट्रॉन के जुड़ने के लिए ऊर्जा का अवशोषण आवश्यक है।
O–(g)+e– → O2-(g); ∆egH = +780.0kJ
इसका कारण यह है कि ऋण आवेशित 0 आयन तथा आने वाले इलेक्ट्रॉन के बीच प्रबल विद्युत स्थैतिक प्रतिकर्षण होता है। इस स्थिति में इलेक्ट्रॉन को जोड़ने के लिए ऊर्जा का अवशोषण आवश्यक है जो विद्युत स्थैतिक प्रतिकर्षण पर विजय प्राप्त करता है। इसी कारण से ऑक्सीजन की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है।
प्रश्न 22.
इलेक्ट्रॉन लब्धि एन्थैल्पी और इलेक्ट्रॉन ऋणात्मकता में क्या मूल अन्तर है?
उत्तर
इलेक्ट्रॉन लब्धि एन्थैल्पी किसी विलगित गैसीय परमाणु की एक अतिरिक्त इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति को संदर्भित करती है, जबकि विद्युत ऋणात्मकता किसी परमाणु के द्वारा सहसंयोजक बध में साझे के युग्मित इलेक्ट्रॉन को अपनी ओर खींचने की प्रवृत्ति है। इस प्रकार ये दोनों गुण एक-दूसरे से बिल्कुल भिन्न हैं, जबकि दोनों एक परमाणु द्वारा इलेक्ट्रॉन को आकर्षित करने की प्रवृत्ति को संदर्भित करते हैं।
प्रश्न 23.
सभी नाइट्रोजन यौगिकों में N की विद्युत ऋणात्मकता पॉलिंग पैमाने पर 3.0 है। आप इस कथन पर अपनी क्या प्रतिक्रिया देंगे?
उत्तर
यह कथन विवादास्पद है क्योंकि एक परमाणु की विद्युत ऋणात्मकता उसके सभी यौगिकों में स्थिर नहीं होती है। यह संकरण अवस्था तथा ऑक्सीकरण अवस्था के साथ बदलती है। उदाहरण के लिए, NO, तथा NO में N की विद्युत ऋणात्मकता, ऑक्सीकरण अवस्थाओं में भिन्नता के कारण, भिन्न होती है।
प्रश्न 24.
उस सिद्धान्त का वर्णन कीजिए, जो परमाणु की त्रिज्या से सम्बन्धित होता है,
(i) जब वह इलेक्ट्रॉन प्राप्त करता है।
(ii) जब वह इलेक्ट्रॉन का त्याग करता है।
उत्तर
(i) जब परमाणु एक या अधिक इलेक्ट्रॉन प्राप्त करता है, तब ऋणायन बनता है। परमाणु के ऋणायन में परिवर्तन के दौरान एक या अधिक इलेक्ट्रॉन परमाणु के संयोजी कोश से जुड़ जाते हैं। नाभिकीय आवेश जनक परमाणु के समान ही रहता है। संयोजी कोश में इलेक्ट्रॉनों की संख्या में वृद्धि, इलेक्ट्रॉनों द्वारा परस्परीय परिरक्षण की अधिकता के कारण, प्रभावी नाभिकीय आवेश को कम कर देती है। परिणामस्वरूप इलेक्ट्रॉन-मेघ विस्तृत हो जाता है अर्थात् आयनिक त्रिज्या बढ़ जाती है।
(ii) जब परमाणु एक या अधिक इलेक्ट्रॉनों का त्याग करता है, तब धनायन बनता है। इस प्रकार प्राप्त धनायन सदैव अपने जनक परमाणु से आकार में छोटा होता है। ऐसा निम्नलिखित कारणों से हो सकता है-
- संयोजी कोश के विलोपन द्वारा (By elimination of valence shell)-कुछ स्थितियों में, इलेक्ट्रॉन त्यागने पर संयोजी कोश को पूर्णतया विलोपन हो जाता है। बाह्यतम कोश विलुप्त होने के कारण धनायन के आकार में कमी आ जाती है।
- प्रभावी नाभिकीय आवेश में वृद्धि के द्वारा (By increase in effective nuclear charge)-धनायन में, इलेक्ट्रॉनों की संख्या जनक परमाणु से कम होती है। कुल नाभिकीय आवेश समान रहता है। यह प्रभावी नाभिकीय आवेश को बढ़ा देता है। परिणामस्वरूप, इलेक्ट्रॉन नाभिक से अधिक दृढ़ता से जुड़े रहते हैं जिससे इनके आकार में कमी आ जाती है।
प्रश्न 25.
किसी तत्व के दो समस्थानिकों की प्रथम आयनन एन्थैल्पी समान होगी या भिन्न? आप क्या मानते हैं? अपने उत्तर की पुष्टि कीजिए।
उत्तर
एक तत्त्व के समस्थानिकों में इलेक्ट्रॉनों की संख्या, परमाणु नाभिकीय आवेश तथा आकार समान होता है। इसलिए इनकी प्रथम आयनन एन्थैल्पी के मान समान होते हैं।
प्रश्न 26.
धातुओं और अधातुओं में मुख्य अन्तर क्या है?
उत्तर
धातुएँ विद्युत धनात्मक तत्त्व हैं तथा एक या अधिक संयोजी इलेक्ट्रॉनों को त्यागकर धनायनों का निर्माण करती हैं। ये एक अपचायक के रूप में कार्य करती हैं तथा इनकी आयनन एन्थैल्पी, इलेक्ट्रॉनिक लब्धि एन्थैल्पी तथा विद्युत ऋणात्मकता का मान कम होता है। ये बेसिक ऑक्साइड्स बनाती हैं। दूसरी तरफ, अधातुएँ विद्युत ऋणात्मक तत्त्व हैं तथा अपने संयोजी कक्ष में एक या अधिक इलेक्ट्रॉन ग्रहण कर ऋणायन बनाने की प्रवृत्ति दर्शाती हैं। ये ऑक्सीकारक के रूप में कार्य करती हैं। इनकी आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा विद्युत ऋणात्मकता के मान अधिक होते हैं। ये अम्लीय ऑक्साइड बनाती हैं।
प्रश्न 27.
आवर्त सारणी का उपयोग करते हुए निम्नलिखित प्रश्नों के उत्तर दीजिए
(क) उस तंव का नाम बताइए जिसके बाह्य उप-कोश में पाँच इलेक्ट्रॉन उपस्थित हों।
(ख) उस तत्व का नाम बताइए जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को त्यागने की हो।
(ग) उस तत्व का नाम बताइए जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को प्राप्त करने की हो।
(घ) उस वर्ग का नाम बताइए जिसमें सामान्य ताप पर धातु, अधातु, द्रव और गैस उपस्थित हों।
उत्तर
(क) F(1s2 2s2 2p5)
(ख) Mg (1s2 2s2 2p6 3s2); Mg → Mg2+ +2 e–
(ग) O(1s2 2s2 2p4); 0+2e– → 02-
(घ) द्रव धातुएँ : Hg (वर्ग 12) तथा Ga (वर्ग 13) हैं।
द्रव अधातुएँ ब्रोमीन (वर्ग 17) हैं। गैसीय अधातुएँ : फ्लुओरीन तथा क्लोरीन (वर्ग 17), ऑक्सीजन (वर्ग 16), नाइट्रोजन (वर्ग 15) इत्यादि।
प्रश्न 28.
प्रथम वर्ग के तत्वों के लिए अभिक्रियाशीलता का बढ़ता हुआ क्रम इस प्रकार है- Li < Na < K < Rb < Cs; जबकि वर्ग 17 के तत्वों में क्रम F > Cl> Br>I है।
इसकी व्याख्या कीजिए।
उत्तर
वर्ग 1 के तत्त्व विद्युत धनात्मक तत्त्व होते हैं तथा संयोजी इलेक्ट्रॉन को त्यागकर एकल धनात्मक धनायन बनाते हैं। इनकी क्रियाशीलता आयनन एन्थैल्पी के मान पर निर्भर करती है। यदि आयनन एन्थैल्पी का मान कम है तो क्रियाशीलता अधिक होती है। चूंकि वर्ग में नीचे जाने पर, आयनन एन्थैल्पी का मान घटता है, अतः प्रथम वर्ग के तत्त्वों की क्रियाशीलता वर्ग में नीचे जाने पर बढ़ती है। (अर्थात् इस क्रम में, Li Cl > Br> I)
प्रश्न 29.
S-, p-, d और f-ब्लॉक के तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर
(i) s-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास ns1-2 (अर्थात् ns1 या ns2) होता है।
(ii) p-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास ns2np1-6 होता है।
(iii) d-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास (n-1) d1-10 ns1-2 होता है।
(iv) f-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास (n-2) f1-14 (n-1) 4d0-1ns2 होता है।
प्रश्न 30.
तत्व, जिसका बाह्य इलेक्ट्रॉनिक विन्यास निम्नलिखित है, का स्थान आवर्त सारणी में बताइए-
(i) ns2np4, जिसके लिए n = 3 है।
(ii) (n-1) d2 ns2, जब n= 4 है तथा
(iii) (n-2)f7 (n-1) d1 ns2, जब n= 6 है।
उत्तर
(i) दिया गया तत्त्व तीसरे आवर्त (n=3) में उपस्थित है तथा इसके संयोजी कक्ष में 6(2+4) इलेक्ट्रॉन उपस्थित हैं। यह एक p-ब्लॉक तत्त्व है क्योंकि विभेदी (differentiating) इलेक्ट्रॉन p-उपकक्ष में प्रवेश करता है।
∴ वर्ग की संख्या = 10+ संयोजी इलेक्ट्रॉनों की संख्या = 10+6= 16
इस प्रकार, यह तत्त्व तीसरे आवर्त तथा वर्ग 16 में स्थित है। यह सल्फर (S) है।
(ii) दिया गया तत्त्व चौथे आवर्त (n=4) में स्थित है। यह एक 4-ब्लॉक तत्त्व है क्योंकि d-उपकोश अपूर्ण है।
∴ वर्ग की संख्या = 2+ (n-1)d इलेक्ट्रॉनों की संख्या = 2+2=4
इस प्रकार यह तत्त्व चौथे आवर्त तथा समूह 4 में स्थित है। यह Ti (टाइटेनियम) है।
(iii) दिया गया तत्त्व छठवें आवर्त में स्थित है। यह एक f-ब्लॉक तत्त्व है क्योंकि विभेदी इलेक्ट्रॉन (n-2)f उपकक्ष में प्रवेश करता है। यह तत्त्व वर्ग 3 में स्थित है क्योंकि सभी f-ब्लॉक के तत्त्वों को तीसरे वर्ग में रखा गया है। यह तत्त्व Gd (gadolinium) है।
प्रश्न 31.
कुछ तत्वों की प्रथम ∆iH1 और द्वितीय ∆iH2 आयनन एन्थैल्पी (kJ mol-1 में) और इलेक्ट्रॉन लब्धि एन्थैल्पी (∆egH) (kJ mol-1 में) निम्नलिखित है-

(क) सबसे कम अभिक्रियाशील धातु है?
(ख) सबसे अधिक अभिक्रियाशील धातु है?
(ग) सबसे अधिक अभिक्रियाशील अधातु है?
(घ) सबसे कम अभिक्रियाशील अधातु है?
(ङ) ऐसी धातु है, जो स्थायी द्विअंगी हैलाइड (binary halide), जिनका सूत्र MX, (X= हैलोजेन) है, बनाता है।
(च) ऐसी धातु, जो मुख्यतः MX (X = हैलोजेन) वाले स्थायी सहसंयोजी हैलाइड बनाती है।
उत्तर
(क) तत्त्व V, क्योंकि इस प्रथम आयनन एन्थैल्पी का मान सर्वाधिक है तथा इलेक्ट्रॉन लब्धि एन्थैल्पी का मान धनात्मक है। यह कर्म क्रियाशील धातु है। यह एक उत्कृष्ट गैस होनी चाहिये।
(ख) तत्त्व II, क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान न्यूनतम तथा इलेक्ट्रॉन लब्धि एन्थैल्पी का मान कम है। इसे अधिक क्रियाशील धातु होना चाहिए। यह एक क्षारीय धातु होनी चाहिए।
(ग) तत्त्व III, क्योंकि इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान उच्च ऋणात्मक तथा प्रथम आयनन एन्थैल्पी का मान पर्याप्त उच्च है। यह एक हैलोजन (halogen) होना चाहिए।
(घ) तत्त्व IV, क्योंकि इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान उच्च ऋणात्मक तथा प्रथम आयनन एन्थैल्पी का मान काफी कम है। इसे सबसे कम क्रियाशील अधातु होना चाहिए। यह सम्भवतः एक ‘ कम क्रियाशील हैलोजन है।
(ङ) तत्त्व VI, क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान यद्यपि कम है, लेकिन फिर भी क्षार धातुओं से अधिक है। इसे एक मृदा क्षारीय धातु होना चाहिए। यह MX, प्रकार के द्विअंगी हैलाइड का निर्माण करेगा।
(च) तत्त्व I, क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान कम है लेकिन द्वितीय आयतन एन्थैल्पी का मान बहुत अधिक है। यह एक क्षारीय धातु है। यह Li होना चाहिए क्योंकि यह सूत्र MX का स्थायी सहसंयोजी हैलाइड बनाता है।
प्रश्न 32.
तत्वों के निम्नलिखित युग्मों के संयोजन से बने स्थायी द्विअंगी यौगिकों के सूत्रों की प्रगुक्ति कीजिए-
(क) लीथियम और ऑक्सीजन
(ख) मैग्नीशियम और नाइट्रोजन
(ग) ऐलुमिनियम और आयोडीन
(घ) सिलिकन और ऑक्सीजन
(ङ) फॉस्फोरस और फ्लुओरीन
(च) 71वाँ तत्व और फ्लुओरीन
उत्तर
(क) लीथियम की संयोजकता (201, वर्ग 1) 1 है, जबकि ऑक्सीजन (2s2 2p4, वर्ग 16) की 2 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक Li20 है।
(ख) मैग्नीशियम (3s2, वर्ग 2) की संयोजकता 2 है, जबकि नाइट्रोजन (2s2 2p4, वर्ग 15) की
संयोजकता 3 है। इसलिये दोनों के मध्य बना द्विअंगी यौगिक Mg3N2 है।
(ग) ऐलुमिनियम (3s2 3p1, समूह 13) की संयोजकता 3 है, जबकि आयोडीन (5s2, 5p5, वर्ग 17) की संयोजकता 1 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक AII3 है।
(घ) सिलिकॉन (3s2 3p2, वर्ग 14) की संयोजकता 4 है, जबकि ऑक्सीजन (2s2 2p4, वर्ग 17) की संयोजकता 2 है। इसलिए दोनों के मध्य बना द्विअंगी यौगिक SiO2 है।
(ङ) फॉस्फोरस (3s2 3p3, वर्ग 15) की संयोजकता 3 तथा 5 है, जबकि फ्लुओरीन (2s2 2p4, वर्ग 17) की संयोजकता 1 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक PF3 अथवा PF5 है।
(च) तत्त्व जिसका परमाणु क्रमांक 71(4f14 5d1 6s2) है, एक लैन्थेनाइड है तथा ल्यूटीशियम : (Lu) है। यह वर्ग 3 में स्थित है। इसकी संयोजकता 3 है। फ्लु ओरीन (2s2 2p5, वर्ग 17) की संयोजकता 1 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक LuF, है।
प्रश्न 33.
आधुनिक आवर्त सारणी में आवर्त निम्नलिखित में से किसको व्यक्त करता है?
(क) परमाणु संख्या
(ख) परमाणु द्रव्यमान
(ग) मुख्य क्वाण्टम संख्या
(घ) दिगंशी क्वाण्टम संख्या
उत्तर
(ग) मुख्य क्वाण्टम संख्या
आधुनिक आवर्त सारणी में, प्रत्येक आवर्त एक नवीन कक्ष के भरने के साथ प्रारम्भ होता है।
प्रश्न 34.
आधुनिक आवर्त सारणी के लिए निम्नलिखित के सन्दर्भ में कौन-सा कथन सही नहीं है।
(क) p-ब्लॉक में 6 स्तम्भ हैं, क्योंकि p-कोश के सभी कक्षक भरने के लिए अधिकतम 6 इलेक्ट्रॉनों की आवश्यकता होती है।
(ख) d-ब्लॉक में 8 स्तम्भ हैं, क्योंकि d-उपकोश के कक्षक भरने के लिए अधिकतम 8 इलेक्ट्रॉनों की आवश्यकता होती है।
(ग) प्रत्येक ब्लॉक में स्तम्भों की संख्या उस उपकोश में भरे जा सकने वाले इलेक्ट्रॉनों की संख्या के बराबर होती है।
(घ) तत्व के इलेक्ट्रॉन विन्यास को भरते समय अन्तिम भरे जाने वाले इलेक्ट्रॉन को उपकोश उसके दिगंशी क्वाण्टम संख्या को प्रदर्शित करता है।
उत्तर
कथन (ख) असत्य है। 4-ब्लॉक में 10 स्तम्भ हैं क्योंकि एक d-उपकक्ष में अधिकतम 10 इलेक्ट्रॉन ही व्यवस्थित हो सकते हैं।
प्रश्न 35.
ऐसा कारक, जो संयोजकता इलेक्ट्रॉन को प्रभावित करता है, उस तत्व की रासायनिक , प्रवृत्ति भी प्रभावित करता है। निम्नलिखित में से कौन-सा कारक संयोजकता कोश को
प्रभावित नहीं करता?
(क) संयोजक मुख्य क्वाण्टम संख्या (n)
(ख) नाभिकीय आवेश (z)
(ग) नाभिकीय द्रव्यमान
(घ) क्रोड इलेक्ट्रॉनों की संख्या
उत्तर
(ग) नाभिकीय द्रव्यमान। नाभिकीय द्रव्यमान संयोजकता कोश को प्रभावित नहीं करता है।
प्रश्न 36.
समइलेक्ट्रॉनिक स्पीशीज F–, Ne और Na+ का आकार इनमें से किससे प्रभावित : होता है?
(क) नाभिकीय आवेश (Z)
(ख) मुख्य क्वाण्टम संख्या (n)
(ग) बाह्य कक्षकों में इलेक्ट्रॉन-इलेक्ट्रॉन अन्योन्यक्रिया
(घ) ऊपर दिए गए कारणों में से कोई भी नहीं, क्योंकि उनका आकार समान है।
उत्तर
(क) नाभिकीय आवेश। समइलेक्ट्रॉनिक आयनों की त्रिज्या नाभिकीय आवेश के बढ़ने पर घटती है। दी गई समइलेक्ट्रॉनिक स्पीशीज में विभिन्न नाभिकीय आवेश हैं और इस प्रकार उनके आकार भिन्न हैं। इनका आकार निम्न क्रम में घटता है-
F– (+9)> Ne(+10)> Na+ (+11)
प्रश्न 37.
आयनन एन्थैल्पी के सन्दर्भ में निम्नलिखित में से कौन-सा असत्य/गलत है?
(क) प्रत्येक उत्तरोत्तर इलेक्ट्रॉन से आयनन एन्थैल्पी बढ़ती है।
(ख) क्रोड उत्कृष्ट गैस के विन्यास से जब इलेक्ट्रॉन को निकाला जाता है, तब आयनन एन्थैल्पी का मान अत्यधिक होता है।
(ग) आयनन एन्थैल्पी के मान में अत्यधिक तीव्र वृद्धि संयोजकता इलेक्ट्रॉनों के विलोपन को व्यक्त करती है।
(घ) कम मान वाले कक्षकों से अधिक n मान वाले कक्षकों की तुलना में इलेक्ट्रॉनों को आसानी से निकाला जा सकता है।
उत्तर
कथन (घ) असत्य है। अधिक » मान वाले कक्षकों से इलेक्ट्रॉनों को आसानी से निकाला जा सकता है, क्योंकि निकलने वाला इलेक्ट्रॉन नाभिक से दूर होता है।
प्रश्न 38.
B, AI, Mg, K तत्वों के लिए धात्विक अभिलक्षण का सही क्रम इनमें कौन-सा है?
(क) B > Al> Mg > K
(ख) Al> Mg > B > K
(ग) Mg > Al> K > B
(घ) K > Mg > Al> B
उत्तर
(घ) K> Mg> Al> B
यह क्रम इसलिए सही है क्योंकि धात्विक गुण आवर्त में आगे बढ़ने पर घटता है। इसलिए, Al, Mg तथा K के धात्विक गुण इस क्रम में होंगे-K > Mg > Al। इसके अतिरिक्त धात्विक गुण एक वर्ग में नीचे जाने पर बढ़ते हैं। अत: B को Al की तुलना में कम धात्विक होना चाहिए।
प्रश्न 39.
तत्वों B, C, N, F और Si के लिए अधातु अभिलक्षण का इनमें से सही क्रम कौन-सा है?
(क) B > C> Si> N > F
(ख) Si> C> B > N > F
(ग) F> N > C> B > Si
(घ) F > N > C > Si > B
उत्तर
(ग) F > N >C>B> Si
यह इसलिए है क्योकि अधातु अभिलक्षण एक आवर्त में बायें से । दायें ओर जाने पर बढ़ते हैं तथा वर्ग में नीचे जाने पर घटते हैं।
प्रश्न 40.
तत्वों F, CI, O और N तथा ऑक्सीकरण गुणधर्मों के आधार पर उनकी रासायनिक अभिक्रियाशीलता का क्रम निम्नलिखित में से कौन-से तत्वों में है?
(क) F > Cl> O > N
(ख) F> O> Cl> N
(ग) Cl> F> O > N
(घ) O> F> N > Cl
उत्तर
(ख) F>O>Cl>N
तत्त्वों का ऑक्सीकारक गुणधर्म एक आवर्त में बायें से दायें चलने पर बढ़ता है तथा वर्ग में नीचे जाने पर घटता है। ऑक्सीजन Cl की तुलना में एक प्रबल ऑक्सीकारक पदार्थ है क्योंकि 0 अधिक विद्युत ऋणात्मक है।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
एक तत्त्व में अन्तिम इलेक्ट्रॉन के लिए चारों क्वाण्टम संख्याओं के माने n = 5;1 = 1; m = -1; s = , हैं। तत्त्व है।
(i) आन्तरिक संक्रमण तत्त्व
(ii) संक्रमण तत्त्व
(iii) अक्रिय गैस
(iv) क्षारीय धातु
उत्तर
(iii) अक्रिय गैस
प्रश्न 2.
निम्न में से कौन-सी धातु एक से अधिक ऑक्सीकरण अवस्था प्रकट करती है?
(i) Na
(ii) Mg
(iii) Al
(iv) Fe
उत्तर
(iv) Fe
प्रश्न 3.
निम्नलिखित आयनों की त्रिज्या का सही क्रम है ।
(i) F– <O2-< Na+<Mg2+
(ii) Mg2+<Na+<F– <O2-
(iii) Na+ <Mg2+<O2-<F–
(iv) O2-<F– < Na+< Mg2+
उत्तर
(ii) Mg2+ <Na+ <F– <O2-
प्रश्न 4.
सर्वाधिक धन-विद्युतीय तत्त्व है।
(i) [He]2s1
(ii) [He]2s2
(iii) [Xe]6s1
(iv) [Xe]6s2
उत्तर
(iii) [Xe]6s1
प्रश्न 5.
धन विद्युती लक्षण का सही क्रम है
(i) Cs > Rb >K > Na> Li।
(ii) Rb>Cs >K> Na >Li
(iii) Li> Na> K> Rb>Cs
(iv) K> Na> Rb>Cs>Li
उत्तर
(i) Cs > Rb >K >Na >Li।
प्रश्न 6.
निम्नलिखित धनायनों की त्रिज्याओं का सही क्रम है।
(i) Li+ > Na+ > Na2+ > Be2+
(ii) Na+ > Mg2+ >Li+ > Be2+
(iii) Na+ > Li+ > Mg2+ > Be2+
(iv) Mg2+ > Na2+ > Li+ > Be2+
उत्तर
(ii) Na+ > Mg2+ > Li+ > Be2+
प्रश्न 7.
ऋण विद्युती लक्षण का सही क्रम है।
(i) I> Br>Cl> F
(ii) Br>Cl> F>I
(iii) F>Cl> Br>I
(iv) Cl> Br>I> F
उत्तर
(iii) F> Cl> Br> I
प्रश्न 8.
निम्नलिखित में से ऋणायनों की त्रिज्याओं का सही क्रम है।
(i) F– > Cl– > S2- >O2-
(ii) S2- > Cl– > O2- > F–
(iii) Cl– > S2- > O2- > F–
(iv) O2- > Cl– > F– > S2-
उत्तर
(ii) S2- > Cl– >O2- > F–
प्रश्न 9.
आयन जिसका प्रथम आयनन विभव निम्न समइलेक्ट्रॉनिक आयनों में सबसे अधिक है, .
(i) Ca2+
(ii) Cl–
(iiii) K+
(iv) S2-
उत्तर
(i) Ca2+
प्रश्न 10.
निम्नलिखित समइलेक्ट्रॉनिक आयनों में सबसे छोटा आयन है।
(i) Na+
(ii) Mg2+
(iii) Al3+
(iv) Si4+
उत्तर
(iv) Si4+
प्रश्न 11.
प्रथम आयनन ऊर्जा का सही क्रम है।
(i) C> B> Be> Li
(ii) C> Be> B> Li
(iii) B>C> Be> Li
(iv) Be> Li> B>C
उत्तर
(ii) C> Be> B> Li
प्रश्न 12.
निम्न में से किसकी आयनन ऊर्जा (आयनन विभव) सबसे अधिक है ?
(i) B
(ii) N
(iii) C
(iv) O
उत्तर
(ii) N
प्रश्न 13.
निम्न में किसका आकार सबसे बड़ा है?
(i) Mg
(ii) Ba
(iii) Be
(iv) Ra
उत्तर
(iv) Ra
प्रश्न 14.
इलेक्ट्रॉन बन्धुता अधिकतम होती है।
(i) F की
(ii) CI की
(iii) Br की
(iv) I की
उत्तर
(i) Cl की
प्रश्न 15.
F, Cl, Br तथा I में तत्त्वों की इलेक्ट्रॉन बन्धुता का घटता क्रम है।
(i) F> Cl> Br>I
(ii) I> Br>Cl> F
(iii) F > Br> Ci>I
(iv) Cl> F > Br>I
उत्तर
(iv) Cl> F > Br>I
प्रश्न 16.
सबसे अधिक विद्युत ऋणात्मक तत्त्व है।
(i) O
(ii) F
(iii) Cl
(iv) N
उत्तर
(ii) F
प्रश्न 17.
C, N, P और Si तत्त्वों की विद्युत ऋणात्मकता के बढ़ने का क्रम है।
(i) C, N, Si, P
(ii) N, Si, C, P
(iii) Si, P, C, N
(iv) P, Si, N, C
उत्तर
(iii) Si, P, C, N
प्रश्न 18.
निम्न में कौन-सा अम्लीय है ?
(i) Na20
(ii) MgO
(iii) SiO
(iv) FeO
उत्तर
(iii) SiO
प्रश्न 19.
दिए गए अम्लों की अम्लीयता का सही क्रम है
(i) HClO4 < HClO3 < HClO2 < HClO
(ii) HClO< HClO2 < HClO3 < HClO4
(iii) HClO < HClO4 < HClO3 < HClO2
(iv) HCIO4 <HClO2 <HClO3 < HClO
उत्तर
(ii) HClO<HClO2 <HCIO3 <HClO4
प्रश्न 20.
निम्नलिखित में किस अणुक प्रजाति में अयुग्मित इलेक्ट्रॉन हैं?
(i) N2
(ii) F2
(iii) O–2
(iv) O2-2
उत्तर
(iii) O–2
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
न्यूलैण्ड का अष्टक नियम लिखिए।
उत्तर
न्यूलैण्ड (1864) ने ज्ञात किया कि तत्वों को उनके बढ़ते हुए परमाणु भारों के क्रम में व्यवस्थित करने पर प्रत्येक आठवें तत्व के गुण प्रथम तत्वों के गुणों से मिलते हैं। इसे ही न्यूलैण्ड का अष्टक नियम कहते हैं।

प्रश्न 2.
परमाणु क्रमांक 19 वाले तत्त्व का आवर्त सारणी में स्थान कारण सहित लिखिए।
उत्तर
परमाणु क्रमांक 19 वाले तत्त्व का इलेक्ट्रॉनिक विन्यास 1s2 , 2s2 2p6 , 3s2 3p6 ,4s1 होता है। चूंकि इसमें चार कोश सम्मिलित हैं; अतः यह चौथे आवर्त का तत्त्व है। चूंकि इसके बाह्यतम कोश में एक इलेक्ट्रॉन s कक्षक में है; अतः यह s-ब्लॉक तथा प्रथम समूह का तत्त्व है।
प्रश्न 3.
आवर्त सारणी में अक्रिय गैसों के स्थान की विवेचना कीजिए।
उत्तर
उत्कृष्ट (अक्रिय) गैसों के बाह्यकोश और आन्तरिक कोश पूर्ण भरे होते हैं। हीलियम (He) का इलेक्ट्रॉनिक विन्यास 152 तथा अन्य उत्कृष्ट गैसों के बाह्यकोश का विन्यास ns- np है। इलेक्ट्रॉनिक विन्यासों में समरूपता, रासायनिक निष्क्रियता और मिलते-जुलते अन्य लक्षणों के कारण उत्कृष्ट गैसों को एक साथ आवर्त सारणी के शून्य वर्ग (18वें) में रखा गया है।
प्रश्न 4.
आवर्त सारणी के किन वर्गों के तत्त्वों को p-ब्लॉक तत्त्व कहते हैं और क्यों?
उत्तर
जिन तत्त्वों में अन्तिम इलेक्ट्रॉन बाह्यतम कोश के p-उपकोश में प्रवेश करता है, p-ब्लॉक तत्त्व कहलाते हैं। आवर्त सारणी में IIIA से VIIA तथा शून्य वर्ग के तत्त्व p-ब्लॉक तत्त्व कहलाते हैं।
प्रश्न 5.
d-ब्लॉक तत्त्वों (संक्रमण तत्त्व) को परिभाषित करते हुए उनकी स्थिति बताइए। या संक्रमण तत्त्व किन्हें कहते हैं? दीर्घ आवर्त सारणी में इनको कहाँ रखा गया है? ऐसे किन्हीं चार तत्त्वों के नाम बताइए।
उत्तर
जिन तत्त्वों में अन्तिम इलेक्ट्रॉन बाह्य कोश (n) से पिछले कोश के 4-ऑर्बिटलों में भरते हैं, d-ब्लॉक तत्त्व या संक्रमण तत्त्व कहलाते हैं। 4-ब्लॉक तत्त्वों के बाह्य कोश का इलेक्ट्रॉनिक विन्यास ns’ या ns होता है तथा पिछले कोश का इलेक्ट्रॉनिक विन्यास (n-1)s2 , p6 ,d1से10 होता है। आवर्त सारणी में संक्रमण तत्त्वों को IB से VIIB उपवर्गों तथा VIII उपवर्ग में -तथा p-ब्लॉक के तत्त्वों के बीच 10 ऊर्ध्वाधर खानों में रखा गया है। उदाहरणार्थ-स्कैण्डियम (Sc), टाइटेनियम (Ti), वैनेडियम (V), क्रोमियम (Cr) आदि।
प्रश्न 6.
कारण देते हुए समझाइए कि संक्रमण तत्त्वों में उत्प्रेरक गुण होता है।
उत्तर
संक्रमण तत्त्वों व उनके यौगिकों में उत्प्रेरक गुण होता है। इन धातुओं का यह गुण उनकी परिवर्ती संयोजकता एवं उनके पृष्ठ में स्थित परमाणुओं की मुक्त संयोजकताओं के कारण होता है।
प्रश्न 7.
किसी तत्त्व का परमाणु क्रमांक 25 है। आवर्त सारणी में इसका स्थान निर्धारित कीजिए।
उत्तर
परमाणु क्रमांक 25 वाला तत्त्व मैंगनीज (Mn) है। इसका इलेक्ट्रॉनिक विन्यास इस प्रकार है।
Mn (25)= 1s2,2s2 2p6,3s2 3p6 3d5,4s2
इस तत्त्व में कुल चार कोश हैं। अत: यह चौथे आवर्त का तत्त्व है। इसमें अन्तिम इलेक्ट्रॉन अन्तिम से दूसरे कोश के 4-उपकोश में जाता है; अतः यह दीर्घ आवर्त सारणी के d-ब्लॉक में है तथा यह एक संक्रमण तत्त्व है और सातवें समूह में उपस्थित है।
प्रश्न 8.
निम्न में सबसे छोटा आयन कौन-सा है ? कारण सहित समझाइए। )
Na+, Mg2+, Al3+
उत्तर
सबसे छोटा आयन Al3+ है। किसी आवर्त में परमाणु क्रमांक बढ़ने पर परमाणु त्रिज्याएँ घटती हैं क्योंकि परमाणु क्रमांक वृद्धि से प्रभावी नाभिकीय आवेश बढ़ता है।
प्रश्न 9.
Li+,Mg2+,K+,Al3+ को बढ़ते हुए आयनिक त्रिज्याओं के क्रम में लिखिए।
उत्तर
Li+< Al3+ < Mg2+ < K+
प्रश्न 10.
Ca2+ तथा K+ में किसकी आयनिक त्रिज्या कम है व क्यों ?
उत्तर
Ca2+ तथा K+ के इलेक्ट्रॉनिक विन्यास इस प्रकार हैं।
Ca2+ = 1s2,2s2 2p6,3s2 3p6
K+ = 1s2,2s2 2p6,3s2 3p6
परन्तु Ca2+ के नाभिक में धनावेश 20 इकाई, K+ के नाभिक में उपस्थित धनावेश 19 इकाई से अधिक है। अत: यह बाह्य इलेक्ट्रॉनों को अधिक तीव्र बल से अपनी ओर आकर्षित करता है। फलतः इसकी आयनिक त्रिज्या कम होती है।
प्रश्न 11.
सोडियम प्रबल विद्युत धनात्मक धातु है जबकि क्लोरीन प्रबल विद्युत ऋणात्मक अधातु कारण सहित स्पष्ट कीजिए।
उत्तर
सोडियम परमाणु के बाह्यतम कोश में केवल एक इलेक्ट्रॉन होता है। अतः यह इसे त्यागकर स्थायी होने की तीव्र प्रवृत्ति रखता है। अतः यह प्रबल वैद्युत धनात्मक है। इसके विपरीत, क्लोरीन परमाणु के ब्राह्यतम कोशे में सात इलेक्ट्रॉन होते हैं। अतः यह एक इलेक्ट्रॉन ग्रहण करके स्थायी विन्यास प्राप्त करने की तीव्र प्रवृत्ति रखता है। अर्थात् यह प्रबल वैधुत ऋणात्मक है।
प्रश्न 12.
C, N, 0 तथा F को इनके बढ़ते हुए प्रथम आयनन विभव के अनुसार व्यवस्थित कीजिए।
उत्तर
C, N, 0 तथा F को इनके बढ़ते हुए प्रथम आयनन विभव के अनुसार इस प्रकार व्यवस्थित करेंगे

प्रश्न 13.
अक्रिय गैसों के आयनन विभव बहुत ऊँचे होते हैं, क्यों ?
उत्तर
आवर्त में उच्चतम आयनन विभव अक्रिय गैस का होता है, क्योंकि उसका संवृत्त कोश इलेक्ट्रॉनिक विन्यास बहुत स्थायी होता है।
प्रश्न 14.
बेरीलियम का प्रथम आयनन विभव बोरॉन से अधिक है। समझाइए।
उत्तर
बेरीलियम का प्रथम आयनन विभव बोरॉन से अधिक है क्योंकि Be के बाह्यकोश में s ऑर्बिटल पूर्ण भरे हुए (ns2) हैं। यह एक अधिक स्थायी व्यवस्था है।
प्रश्न 15.
कारण सहित बताइए कि नाइट्रोजन का प्रथम आयनन विभव ऑक्सीजन से अधिक होता है।
उत्तर
7N= 1s2,2s2,2p1x,2p1y, 2p1z;
8O= 1s2, 2s2,2p2x,2p1y, 2p1z
इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि नाइट्रोजन के 2p-ऑर्बिटल आधे भरे हुए हैं। नाइट्रोजन के p-ऑर्बिटल में समदिश चक्रण के 3 अयुग्मित इलेक्ट्रॉन हैं जिससे N का इलेक्ट्रॉनिक विन्यास O की अपेक्षा अधिक स्थायी है। अत: N का प्रथम आयनन विभव O से अधिक होता है।
प्रश्न 16.
तत्त्वों के द्वितीय आयनन विभव का मान सदैव प्रथम आयनन विभव से अधिक क्यों होता है?
उत्तर
परमाणु से प्रथम इलेक्ट्रॉन निकलने के बाद बने धनायन से दूसरे इलेक्ट्रॉन का निकलना बहुत कठिन हो जाता है, क्योंकि शेष बचे इलेक्ट्रॉनों पर नाभिकीय आकर्षण बल बढ़ जाता है। अतः द्वितीय आयनन विभव का मान प्रथम आयनन विभवे से अधिक होता है।
प्रश्न 17.
निम्नलिखित तत्त्वों को बढ़ते हुए आयनन विभव के क्रम में लिखिए
6A12,8B16,8C16,9D18
उत्तर
उपर्युक्त तत्त्वों के आयनन विभव का बढ़ता क्रम निम्नवत् है-
6A12 < 8B16 <8C16 <9D18
प्रश्न 18.
फॉस्फोरस का प्रथम आयनन विभव सल्फर से अधिक होता है। स्पष्ट कीजिए।
उत्तर
चूँकि आवर्त सारणी में किसी वर्ग में ऊपर से नीचे की ओर चलने पर आयनन विभव घटता है; इसलिए फॉस्फोरस (पंचम वर्ग) का प्रथम आयनन विभव सल्फर (षष्ठम् वर्ग) से अधिक होता
प्रश्न 19.
P, S, Cl तथा F में से किसकी ऋणात्मक इलेक्ट्रॉन-लब्धि एन्थैल्पी अधिकतम तथा किसकी न्यूनतम होगी? समझाइए।
उत्तर
हम जानते हैं कि आवर्त में बायीं ओर से दायीं ओर बढ़ने पर इलेक्ट्रॉन-लब्धि एन्थैली बढ़ती जाती है, जबकि वर्ग में ऊपर से नीचे की ओर बढ़ने पर यह घटती जाती है। 3p-कक्षक में इलेक्ट्रॉन प्रवेश कराने की तुलना में जब 2p-कक्षक में इलेक्ट्रॉन जाता है, तब इलेक्ट्रॉन प्रतिकर्षण अधिक होता है। अतः अधिकतम ऋणात्मक इलेक्ट्रॉन-लब्धि एन्थैल्पी क्लोरीन की होगी तथा सबसे कम ऋणात्मक इलेक्ट्रॉन-लब्धि एन्थैल्पी फॉस्फोरस की होगी।
प्रश्न 20.
Cu+ आयन प्रतिचुम्बंकीय है, जबकि Cu2+ आयन अनुचुम्बकीय है, क्यों? समझाइए।
उत्तर
Cu+ आयन का इलेक्ट्रॉनिक विन्यास इस प्रकार है।
Cu+:1s2,2s2 2p6,3s2 3p6 3d10
Cu+आयन में सभी उपकोश पूर्ण भरे हैं और सभी इलेक्ट्रॉन युग्मित हैं, अत: Cu+ प्रतिचुम्बकीय है।
Cu2+ का इलेक्ट्रॉनिक विन्यास इस प्रकार है।
Cu2+ : 1s2,2s2 2p6,3s2 3p6 3d9
Cu2+ आयन में 3d उपकोश अपूर्ण है तथा इसमें एक अयुग्मित इलेक्ट्रॉन है।
अत: Cu2+ आयन अनुचुम्बकीय है।
प्रश्न 21.
Mg2+,O2-,Na+ तथा F को आकार के घटते हुए क्रम में लिखिए।
उत्तर
O2->F–> Na+ > Mg2+
प्रश्न 22.
समझाइए कि क्यों Mg2+ आयन O2- आयन से छोटा है, यद्यपि दोनों की इलेक्ट्रॉनिक संख्या समान है?
उत्तर
Mg2+ आयन में 12 प्रोटॉन तथा 02- आयन में 8 प्रोटॉन हैं, फलत: Mg2+ आयन में उसके इलेक्ट्रॉनों पर लगने वाला नाभिकीय आकर्षण बल O2- से ज्यादा होगा जिससे इसका आकार O2- से छोटा हो जाएगा।
प्रश्न 23.
आवर्त में बाएँ से दाएँ जाने पर आयनन ऊर्जा बढ़ती है, किन्तु Al की प्रथम आयनन ऊर्जा Mg से कम होती है। क्यों? समझाइए।
उत्तर
Al: 13 = 1s2, 2s2 2p6, 3s2 3p1
Mg : 12 = 1s2, 2s2 2p6, 3s2
Mg के 3s के इलेक्ट्रॉन की वेधन मात्रा अर्थात् नाभिक से निकटता AI के 3p की तुलना में अधिक है। इसलिए Mg का प्रथम आयनन विभव Al से अधिक है।
प्रश्न 24.
N3-,Na+,F–,O2- तथा Mg2+ को आयनिक आकार के बढ़ते क्रम में लिखिए।
उत्तर
Mg2+<Na+ <F– <O2- <N3-
प्रश्न 25.
निम्न को समझाइए।
F– आयन Na+ आयन से बड़े आकार का होता है।
उत्तर
F– में इलेक्ट्रॉन की संख्या = 10 तथा प्रोटॉन की संख्या = 9
Na+ में इलेक्ट्रॉन की संख्या = 10 तथा प्रोटॉन की संख्या =11
Na+ में कार्यरत् प्रभावी नाभिकीय आवेश F से अधिक है इसलिए F का आकार Na+ से बड़ा है।
प्रश्न 26.
अक्रिय गैसों की इलेक्ट्रॉन बन्धुता शून्य होती है, क्यों? समझाइए।
उत्तर
अक्रिय गैसों की इलेक्ट्रॉन बन्धुता शून्य होती है, क्योंकि इनके कक्षों के इलेक्ट्रॉन कक्षक पूर्णतया भरे होने के कारण इनमें अतिरिक्त इलेक्ट्रॉन प्रवेश नहीं कर सकता है।
प्रश्न 27.
नाइट्रोजन की इलेक्ट्रॉन बन्धुता कार्बन से कम होती है। कारण दीजिए।
उत्तर
क्योंकि नाइट्रोजन में 5 उपकोश पूर्ण तथा p उपकोश आधा भरा होता है।
प्रश्न 28.
F, CI, Br, I को उनके बढ़ते हुए इलेक्ट्रॉन बन्धुता के क्रम में तथा Li, Na, K, Rb को उनके बढ़ते हुए विद्युत ऋणात्मकता के क्रम में लिखिए।
उत्तर

प्रश्न 29.
F, O, Cl की इलेक्ट्रॉन बन्धुता घटने का क्रम लिखिए।
उत्तर
F, O, Cl की इलेक्ट्रॉन बन्धुता घटते क्रम में निम्नवत् है–
Cl> F>O
प्रश्न 30.
O, F, Be, C, N को घटती हुई इलेक्ट्रॉन बन्धुता के क्रम में व्यवस्थित कीजिए।
उत्तर
O, F, Be, C तथा N की घटती हुई इलेक्ट्रॉन बन्धुता का क्रम निम्नवत् है–
F>O>N>C> Be
प्रश्न 31.
Cl–,s2-,ca2+,Ar को आकार के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर
Cl–,s2-,Ca2+ तथा Ar का बढ़ते हुए आकार को क्रम निम्नवत् है-
Ca2+< Ar<Cl–,S2-
प्रश्न 32.
F, CI, Br तथा I को बढ़ती हुई ऋण-विद्युतता के अनुसार व्यवस्थित कीजिए।
उत्तर
बढ़ती हुई ऋण-विद्युतता के अनुसार F, CI, Br तथा I की व्यवस्था इस प्रकार है।

लघु उत्तरीय प्रश्न
प्रश्न 1.
आवर्त सारणी के किन-किन वर्गों के तत्त्वों को 5-ब्लॉक तत्त्व कहते हैं और क्यों ? इन तत्वों के किन्हीं चार मुख्य अभिलक्षणों को लिखिए।
उत्तर
तत्त्वों के परमाणु क्रमांक की वृद्धि के साथ जब उनके बाह्यतम कोश के -उपकोश में इलेक्ट्रॉन प्रवेश करते हैं, उन्हें ब्लॉक तत्त्व कहते हैं। इन तत्त्वों के बाह्य कोश का इलेक्ट्रॉनिक विन्यास या अभिलाक्षणिक इलेक्ट्रॉनिक विन्यास ns’ या nsहोता है तथा (n-1) कोश में प्रायः 8 इलेक्ट्रॉन (H, Li वे Be को छोड़कर) होते हैं।
वर्ग 1-A (Li, Na, K, Rb, Cs, Fr) तथा वर्ग II-A (Be, Mg, Ca, Sr, Ba, Ra) के तत्त्व -ब्लॉक तत्त्व : होते हैं। हाइड्रोजन और हीलियम भी ब्लॉक के तत्त्व हैं। इनमें I-A उपवर्ग के तत्त्वों को क्षारीय धातु (H को छोड़कर) कहते हैं तथा II-A उपवर्ग के तत्त्वों को क्षारीय मृदा धातुएँ कहते हैं।
S-ब्लॉक के तत्त्वों के गुणधर्म
- इलेक्ट्रॉनिक विन्यास-इन तत्त्वों के बाह्य कोश के 3-उपकोश में 1 या 2 इलेक्ट्रॉन तथा उससे पहले कोश में सभी उपकोश पूर्ण भरे होते हैं।
- संयोजकता—इन तत्त्वों की एक निश्चित संयोजकता होती है, जो उनके बाह्य कोश के इलेक्ट्रॉनों की संख्या के बराबर होती है; अतः I-A के क्षार धातुओं (जैसे-Li, Na, K आदि) की संयोजकता 1 तथा II-A के क्षारीय मृदा धातुओं (जैसे-Mg, Ca, Sr) की संयोजकता 2 होती है।
- परमाणु त्रिज्या–हाइड्रोजन तथा हीलियम को छोड़कर सभी 5-ब्लॉक तत्त्वों की परमाणु त्रिज्या अपेक्षाकृत काफी बड़ी होती है; जैसे-Li (1.23 A), Mg (1.36 A) आदि।।
- आयनन विभव-हाइड्रोजन तथा हीलियम को छोड़कर, सभी 5-ब्लॉक तत्त्वों के आयनन विभव निम्न होते हैं; जैसे—Li (5.4 eV), Mg (7.6 ev) आदि। इस कारण ये तत्त्व प्रबल धन-विद्युती (electropositive) हैं तथा बाह्यतम कोश के इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति रखते हैं।
उदाहरणार्थ-Na+, K+, Mg2+, Ca2+ आदि।
प्रश्न 2.
d-ब्लॉक तत्त्वों के प्रमुख लक्षण (विशेषताएँ या गुण क्या हैं?
उत्तर
d-ब्लॉक तत्त्वों को संक्रमण तत्त्व कहते हैं। इनके मुख्य लक्षण/गुण/विशेषताएँ इस प्रकार
- इन तत्त्वों में बाह्य कोश (n) से पिछले कोश (n-1) के 4-ऑर्बिटलों में इलेक्ट्रॉन भरते हैं। इन तत्त्वों के बाह्य कोश में 1 या 2 इलेक्ट्रॉन तथा उससे पिछले कोश में 9 से 18 इलेक्ट्रॉन तक होते हैं।
- ये परिवर्ती संयोजकता प्रदर्शित करते हैं।
- ये सभी तत्त्व धातु हैं। इन धातुओं के क्वथनांक, गलनांक तथा घनत्व ऊँचे होते हैं। ये सभी | तत्त्व ऊष्मा तथा वैद्युत के कुचालक होते हैं और मिश्र धातु बनाने का गुण भी व्यक्त करते हैं।
- ये तत्त्व अनुचुम्बकीय (paramagnetic) होते हैं, क्योंकि (n-1) 4-उपकोश में प्रायः अयुग्मित इलेक्ट्रॉन होते हैं।
- इन तत्त्वों के जिन आयनों में (n-1)d उपकोश पूरा भरा नहीं होता है उनके आयन तथा यौगिक रंगीन होते हैं; जैसे-Cu2+ आयन (4) तथा क्यूप्रिंक यौगिक नीले रंग के होते हैं।
- ये तत्त्व और इनके यौगिक उत्प्रेरक गुण प्रदर्शित करते हैं।
- ये संकर आयन बनाने की प्रवृत्ति रखते हैं।
प्रश्न 3.
आयनन विभव की परिभाषा लिखिए। किसी वर्ग में परमाणु क्रमांक बढ़ने के साथ आयनन विभव/ऊर्जा पर क्या प्रभाव पड़ता है?
उत्तर
किसी तत्त्व के एक विलग, (isolated) गैसीय परमाणु में से एक इलेक्ट्रॉन निकालने के लिए जितनी ऊर्जा की आवश्यकता होती है, उसे तत्त्व का आयनन विभव या प्रथम आयनन विभव कहते हैं। इसी प्रकार दूसरे तथा तीसरे इलेक्ट्रॉनों को बाहर निकालने के लिए प्रयुक्त ऊर्जा को क्रमशः द्वितीय आयनन विभव तथा तृतीय आयनन विभव कहते हैं।
आयनन विभव को इलेक्ट्रॉन वोल्ट (ev) या किलो कैलोरी प्रति मोल (kcal/mol) या किलो जूल प्रति मोल (kJ/mol) में व्यक्त करते हैं। किसी आवर्त में बाएँ से दाएँ जाने पर अर्थात् परमाणु क्रमांक में वृद्धि से नाभिकीय आवेश में वृद्धि होती है और परमाणु का आकार कम होने लगता है जिससे परमाणु के आयनीकरण में अधिक ऊर्जा प्रयुक्त होती है जिससे आयनन विभव का मान बढ़ जाता है।

किसी वर्ग में ऊपर से नीचे जाने पर अर्थात् परमाणु क्रमांक में वृद्धि के साथ इनके परमाणु आकार में वृद्धि होती है जिससे नाभिकीय आवेश का बाहरी कक्षाओं के इलेक्ट्रॉन पर आकर्षण कम हो जाता है। और इलेक्ट्रॉनों को निकालने में कम ऊर्जा लगती है जिससे आयनन विभव का मान कम हो जाता है।

प्रश्न 4.
इलेक्ट्रॉन बन्धुता की परिभाषा दीजिए। क्लोरीन की इलेक्ट्रॉन बन्धुता फ्लोरीन से अधिक है। स्पष्ट कीजिए।
या
आवर्त सारणी में किसी आवर्त तथा वर्ग में इलेक्ट्रॉन बन्धुता में क्या परिवर्तन होता है? समझाइए।
उत्तर
किसी तत्त्व के परमाणु द्वारा इलेक्ट्रॉन ग्रहण करके ऋण आयन बनने में उत्सर्जित ऊर्जा को उस तत्त्व की इलेक्ट्रॉन बन्धुता कहते हैं। ऊर्जा का उत्सर्जन जितना अधिक होगा, इलेक्ट्रॉन बन्धुता उतनी ही अधिक होगी। हैलोजनों की इलेक्ट्रॉन बन्धुता सबसे अधिक होती है। इलेक्ट्रॉन बन्धुता इलेक्ट्रॉन वोल्ट (eV) प्रति परमाणु में व्यक्त की जाती है तथा E या E, अक्षरों द्वारा व्यक्त की जाती है।
Cl+e– → Cl– + E यहाँ E = 3.61 ev
आवर्त में आगे की ओर जाने पर इलेक्ट्रॉन बन्धुता बढ़ती है तथा वर्ग में नीचे की ओर जाने पर यह घटती है।
क्लोरीन की इलेक्ट्रॉन बन्धुता फ्लोरीन से अधिक है क्योंकि फ्लोरीन परमाणु की त्रिज्या बहुत छोटी एवं इलेक्ट्रॉन घनत्व बहुत उच्च होने के कारण फ्लोरीन परमाणु में इलेक्ट्रॉन डालना ऊर्जा की दृष्टि से क्लोरीन परमाणु की तुलना में कुछ कम अनुकूल होता है। इसलिए फ्लोरीन की इलेक्ट्रॉन बन्धुता क्लोरीन से कम है।
प्रश्न 5.
वैद्युत ऋणात्मकता किसे कहते हैं? आवर्त सारणी में बाएँ से दाएँ जाने पर वैद्युत ऋणात्मकता किस प्रकार परिवर्तित होती है?
या
वैद्युत ऋणात्मकता पर टिप्पणी लिखिए।
उत्तर
किसी यौगिक के परमाणु द्वारा इलेक्ट्रॉनों को आकर्षित करने की प्रवृत्ति को उस परमाणु की वैद्युत ऋणात्मकता कहा जाता है। वे परमाणु जिनके नाभिक अधिक धनात्मक होते हैं और जिनकी त्रिज्याएँ कम होती हैं, अधिक वैद्युत ऋणात्मक होते हैं।
आवर्त सारणी के किसी आवर्त में बाएँ से दाएँ जाने पर अर्थात् परमाणु क्रमांक में वृद्धि से वैद्युत ऋणात्मकता बढ़ती है क्योंकि परमाणु त्रिज्याएँ घटती हैं, जबकि वर्ग में ऊपर से नीचे आने अर्थात् परमाणु क्रमांक बढ़ने से वैद्युत ऋणात्मकता प्राय: घटती है क्योंकि परमाणु त्रिज्याएँ क्रम से बढ़ती हैं। उदाहरणार्थ।

अक्रिय गैसों (Ar, Ne) इत्यादि में इलेक्ट्रॉनों को आकर्षित करने की प्रवृत्ति नहीं होती है, अत: उनकी वैद्युत ऋणात्मकता शून्य होती है।
उपरोक्त वर्णन से स्पष्ट है कि फ्लोरीन हैलोजन वर्ग में सबसे ऊपर है अत: इसकी वैद्युत ऋणात्मकता सबसे अधिक है।
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
आधुनिक आवर्त नियम के आधार पर बनी दीर्घ आवर्त सारणी की मुख्य विशेषताओं का उल्लेख कीजिए।
उत्तर
दीर्घाकार आवर्त सारणी का निर्माण बोर के परमाणु की कक्षाओं में इलेक्ट्रॉनों के वितरण के सिद्धान्त के आधार पर हुआ है। अतः इसे बोर की आवर्त सारणी भी कहते हैं। इस सारणी के मुख्य लक्षण/विशेषताएँ/गुण इस प्रकार हैं।
- दीर्घाकार आवर्त सारणी में मेंडलीव की आवर्त सारणी की भाँति ही क्षैतिज पंक्तियों की संख्या 7 है जिन्हें आवर्त कहते हैं (अर्थात् आवर्तों की कुल संख्या 7 है) जबकि ऊर्ध्वाधर स्तम्भों की कुल संख्या 18 है जिन्हें वर्ग या समूह अथवा परिवार या फेमिलीज कहते हैं, अर्थात् इनमें वर्गों की कुल संख्या 18 है। इस आवर्त सारणी में बाईं ओर से दाईं ओर चलने पर उपर्युक्त वर्गों को निम्नलिखित रूप में व्यवस्थित किया गया है।
I-A, II-A, III-B, IV-B, V-B, VI-B, VII-B, VIII, VIII, VIII, I-B, II-B, III-A, IV-A, V-A, VI-A, VII-A तथा शून्य। IUPAC पद्धति के अनुसार आजकल ये वर्ग क्रमशः 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 व 18 तक वर्गों के रूप में भी व्यक्त किए जाते हैं। इन वर्गों को आजकल क्रसश: 1 से 18 वर्गों के रूप में भी व्यक्त किया जाता है। , इनमें VIII वर्ग में तीन ऊर्ध्वाधर स्तम्भ हैं, अर्थात् VIII वर्ग तीन ऊध्र्वाधर स्तम्भों में रखा गया है। - इस सारणी के आवर्गों में पहले, दूसरे, तीसरे, चौथे, पाँचवें तथा छठे आवर्गों में क्रमश: तत्त्वों की संख्याएँ 2, 8, 8, 18 तथा 32 हैं, इनको मैजिक संख्याएँ कहते हैं, जबकि सातवाँ आवर्त अपूर्ण है।
- इस सारणी में छठे आवर्त के 14 तत्त्वों, परमाणु क्रमांक 58 से 71 तक को और सातवें आवर्त के 14 तत्त्वों, परमाणु क्रमांक 90 से 103 तक को दो श्रेणियों में क्रमशः लैन्थेनाइड तथा ऐक्टिनाइड के रूप में सारेणी के नीचे रखा गया है।
- प्रत्येक आवर्त का प्रथम तत्त्व क्षार धातु तथा अन्तिम तत्त्व अक्रिय गैस है; जैसे-तृतीय आवर्त का पहला तत्त्व Li (क्षार धातु) तथा अन्तिम तत्त्व Ne (अक्रिय गैस) है।
- इस सारणी में तत्त्वों को परमाणु क्रमांक के वृद्धि क्रम में उस समय तक श्रेणीबद्ध किया गया है जब तक कि समान गुण वाला तत्त्व पुन: नहीं आ गया है।
- इस सारणी में प्रत्येक आवर्त में एक नई मुख्य क्वाण्टम संख्या के साथ बाह्यतम कक्ष में ” इलेक्ट्रॉन भरना शुरू होता है और बाह्यतम कक्ष के पूर्ण होने के साथ आवर्त समाप्त हो जाता है। किसी आवर्त की क्रम संख्या उस आवर्त के तत्त्वों की बाह्यतम कक्ष की मुख्य क्वाण्टम संख्या होती है।
- इस सारणी में शून्य वर्ग के तत्त्वों को अक्रिय गैस कहते हैं; क्योंकि इनकी सभी उपकक्षाएँ पूर्ण होती हैं।
- इस सारणी में I-A उपवर्ग (H को छोड़कर) के तत्त्वों को क्षारीय धातु तथा II-A उपवर्ग के तत्त्वों को क्षारीय मृदा धातुएँ कहते हैं।
- इस सारणी में III-A, IV-A, V-A, VI-A तथा VII-A उपवर्गों या वर्गों में तत्त्वों को सामान्य .तत्त्व कहते हैं, जिसमें धातु, अधातु एवं उपधातु हैं।
- इस सारणी में III-B, IV-B, V-B, VI-B, VII-B, VIII, I-B, II-B उपवर्गों या वर्गों के तत्त्वों को | संक्रमण तत्त्व कहते हैं क्योंकि इन तत्त्वों को क्षार धातुओं तथा सामान्य तत्त्वों के बीच में रखा गया
- इस सारणी में उपस्थित किसी उपवर्ग या वर्ग के सभी तत्त्वों की बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉनों की संख्याएँ समान होने के कारण उनका इलेक्ट्रॉनिक विन्यास एकसमान होता है। के कारण उनके गुणों में समानताएँ होती हैं। किसी भी उपवर्ग या वर्ग में ऊपर से नीचे की ओर चलने पर तत्त्वों के परमाणु क्रमांकों की वृद्धि के साथ, उपकक्षों की संख्या में भी वृद्धि होती है जिसके कारण उन तत्त्वों के गुणों में भी क्रमिक परिवर्तन होता है।
- इस सारणी में तत्त्वों को उनके इलेक्ट्रॉनिक विन्यास के आधार पर चार ब्लॉकों में विभक्त किया गया है।
- s-ब्लॉक
- p-ब्लॉक,
- 4-ब्लॉक तथा
- f-ब्लॉक।
प्रश्न 2.
इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में तत्त्वों का वर्गीकरण लिखिए। या प्रवर्धित आवर्त सारणी के प्रारूप को 5, p, d व f-ब्लॉक के तत्वों के आधार पर
समझाइए।
उत्तर
तत्त्वों के इलेक्ट्रॉनिक विन्यास तथा आवर्त सारणी किसी परमाणु के कक्षकों में इलेक्ट्रॉनों का वितरण उसका इलेक्ट्रॉनिक विन्यास कहलाता है। किसी तत्त्व के इलेक्ट्रॉनिक विन्यास और उसकी आवर्त सारणी में स्थिति में सीधा सम्बन्ध होता है। किसी तत्त्व की आवर्त सारणी में स्थिति से, भरें जाने वाले अन्तिम कक्ष की मुख्य क्वाण्टम संख्या (n) और दिगंशी, क्वाण्टम संख्या (l) के विषय में भी जानकारी मिलती है।
आवर्त में तत्त्वों के इलेक्ट्रॉनिक विन्यास
आवर्त बाह्यतम कोश के लिए n का मान बताता है। आवर्त 1, 2, 3,… आदि का तात्पर्य क्रमशः 1, 2, 3,… आदि मुख्य ऊर्जा स्तरों के भरने से है। प्रत्येक आवर्त में तत्त्वों की संख्या, भरे जाने वाले ऊर्जा स्तर में उपलब्ध परमाणु कक्षकों की संख्या से दोगुनी होती है।
प्रथम आवर्त में इलेक्ट्रॉन प्रथम ऊर्जा स्तर (n=1) में भरते हैं। इस आवर्त में केवल एक कक्षक (ls) होता है और इलेक्ट्रॉन इसी में भरते हैं। इसमें दो तत्त्व हाइड्रोजन (Z= 1) और हीलियम (Z=2) होते हैं। जिनके इलेक्ट्रॉनिक विन्यास क्रमशः 1s1 तथा 1s2 होते हैं।
दूसरे आवर्त में इलेक्ट्रॉन दूसरे ऊर्जा स्तर (n= 2) में भरते हैं। यह आवर्त लीथियम (z= 3) से शुरू होता है जिसमें दो इलेक्ट्रॉन 1s कक्षक में होते हैं और तीसरा इलेक्ट्रॉन 2s कक्षक में प्रवेश करता है (1s+ 2s1), अगले तत्त्व बेरीलियम (Z = 4) में 1s तथा 2s दोनों कक्षकों में 2-2 इलेक्ट्रॉन होते हैं (1s2 2s2) इसके पश्चात् बोरॉन (Z= 5) से निऑन (Z = 10) तक पहुँचने पर 2p कक्षक पूर्ण रूप से इलेक्ट्रॉनों से भर जाता है। इस तरह L कोश (n=2) निऑन (1s2,2s2 2p6) तत्त्व के साथ पूर्ण हो जाता है।
तीसरे आवर्त में इलेक्ट्रॉन तीसरे ऊर्जा स्तर (n=3) में भरते हैं। यह आवर्त सोडियम (Z= 11) से शुरू होता है। इसमें इलेक्ट्रॉन 3s कक्षक में प्रवेश करता है। इस आवर्त में सोडियम (3s1) से लेकर आर्गन (3s2 3p6) तक उत्तरोतर 3s एवं 3p कक्षकों में इलेक्ट्रॉन भरते हैं। 3d कक्षकों की ऊर्जा 4s कक्षकों से अधिक होती है इसलिए वे 4s कक्षकों के पश्चात् भरते हैं। चौथे आवर्त में इलेक्ट्रॉन चौथे ऊर्जा स्तर (n=4) में भरते हैं। यह आवर्त पोटैशियम (Z=19) से प्रारम्भ होता है और इसमें इलेक्ट्रॉन 4s कक्षक में प्रवेश करता है। कैल्सियम (Z = 20) में 4s कक्षक भर जाता है। चूंकि 3d-कक्षकों की ऊर्जा 4p-कक्षकों से कम होती है इसलिए 4p-कक्षकों से पहले 3d-कक्षकों में इलेक्ट्रॉन भरते हैं। इस प्रकार हमें तत्त्वों की 3d संक्रमण श्रेणी (transition series) प्राप्त होती है। यह स्कैण्डियम (Z=21) से प्रारम्भ होती है। इसको बाह्य इलेक्ट्रॉनिक विन्यास 3d 4s होता है। 3d-कक्षक जिंक (Z= 30) पर पूर्ण रूप से भर जाता है। इसका बाह्य इलेक्ट्रॉनिक विन्यास 3d10 4s2 होता है। इसके पश्चात् गैलियम (z=31) से 4p-कक्षक का भरना प्रारम्भ होता है जो क्रिप्टॉन पर समाप्त होता है। क्रिप्टॉन का बाह्य इलेक्ट्रॉनिक विन्यास 4s2 3d10 4p6 होता है। इस आवर्त में 18 तत्त्व होते हैं तथा इसमें 9’कक्षक भरते हैं। 4d और 4f-कक्षकों की ऊर्जा अधिक होने के कारण वे इस आवर्त में नहीं भरते हैं। पाँचवें आवर्त में इलेक्ट्रॉन पाँचवें ऊर्जा स्तर (n = 5) में भरते हैं। यह आवर्त रूबिडियम (Z=37) से प्रारम्भ होता है जिसमें 1 इलेक्ट्रॉन 5s-कक्षक में प्रवेश करता है। 55-कक्षक के भरने के पश्चात् 4d संक्रमण श्रेणी प्रारम्भ हो जाती है जिसमें इलेक्ट्रॉन 4d-कक्षकों में भरते हैं। यह इट्रियम (Z= 39) से प्रारम्भ होकर कैडमियम (Z=48) पर समाप्त होती है। इसके पश्चात् 5p-कक्षक भरते हैं। इनका भरना इंडियम (Z= 49) से प्रारम्भ होकर जीनॉन (Z=54) पर समाप्त होता है। छठे आवर्त में इलेक्ट्रॉन छठे ऊर्जा स्तर (n= 6) में भरते हैं। यह आवर्त सीजियम (Z = 55) से प्रारम्भ होता है जिसमें 1 इलेक्ट्रॉन 6s-कक्षक में प्रवेश करता है। 6s-कक्षक के भरने के पश्चात् अगला इलेक्ट्रॉन La में 5d-कक्षक में प्रवेश करता है। इसके पश्चात् सीरियम (Z= 58) से प्रारम्भ करके ल्यूटीशियम (Z= 71) तक इलेक्ट्रॉन 4f-कक्षकों में भरते हैं। इसे 4 आंतरिक संक्रमण श्रेणी (inner transitional series) या लैन्थेनाइड श्रेणी (lanthanide series) कहते हैं। इसके पश्चात् हैफनियम (Z = 72) से मर्करी (Z = 80) तक इलेक्ट्रॉन 5d-कक्षकों में भरते हैं। इस प्रकार 54 सक्रमण श्रेणी प्राप्त होती है। इसके पश्चात् इलेक्ट्रॉन थैलियम (Z= 81) से रेडॉन (Z= 86) तक 6p-कक्षकों में भरते हैं।
सातवें आवर्त में इलेक्ट्रॉन सातवें ऊर्जा स्तर (n= 7) में भरते हैं। यह आवर्त फ्रैंशियम (Z = 87) से प्रारम्भ होता है जिसमें 7s-कक्षक में 1 इलेक्ट्रॉन प्रवेश करता है। 7s-कक्षक के भरने के पश्चात् ऐक्टिनियम (Z = 89) और थोरियम (Z=90) में इलेक्ट्रॉन 6d-कक्षक में प्रवेश करते हैं और उसके पश्चात् 5f-कक्षकों का भरना शुरू होता है। यह प्रोऐक्टिनियम (Z=91) से लॉरेन्शियम (Z = 103) तक चलता है। इस प्रकार 5f आंतरिक संक्रमण श्रेणी या ऐक्टिनाइड श्रेणी (actinide series) प्राप्त होती है। ऐक्टिनियम (Z= 89) से Uub (Z = 112) तक 6d-कक्षक भरते हैं और हमें 6d संक्रमण श्रेणी प्राप्त होती है। 6d-कक्षकों के भरने के पश्चात् 7p-कक्षक भरते हैं।
वर्गवार इलेक्ट्रॉनिक विन्यास
एक ही वर्ग के सभी तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास (संयोजकता कोश इलेक्ट्रॉनिक विन्यास) समान होते हैं। इनके बाह्य कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या एवं गुणधर्म भी समान होते हैं।
उदाहरणार्थ-Li, Na, K, Rb, Cs और Fr सभी का संयोजकता कोश इलेक्ट्रॉनिक विन्यास ns1 है। तथा वे सभी समान गुण प्रदर्शित करते हैं। इस प्रकार स्पष्ट है कि किसी तत्त्व के गुण उसके परमाणु क्रमांक पर निर्भर करते हैं न कि उसके सापेक्षिक परमाणु द्रव्यमान पर।


तत्त्वों का s, p, a तथा f ब्लॉकों में वर्गीकरण
प्रवर्धित आवर्त सारणी के विभिन्न तत्त्वों को चार ब्लॉकों (s, p, d तथा f) में वर्गीकृत किया गया है। इनका यह वर्गीकरण उनके उस कक्षक के नाम पर किया गया है जिसमें अन्तिम इलेक्ट्रॉन प्रवेश करता है।

We hope the UP Board Solutions for Class 11 Chemistry Chapter 3 Classification of Elements and Periodicity in Properties (तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता) help you.