UP Board Solutions for Class 11 Chemistry Chapter 7 Equilibrium (साम्यावस्था)
UP Board Solutions for Class 11 Chemistry Chapter 7 Equilibrium (साम्यावस्था)
पाठ के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
एक द्रव को सीलबन्द पात्र में निश्चित ताप पर इसके वाष्प के साथ साम्य में रखा जाता है। पात्र का आयतन अचानक बढ़ा दिया जाता है।
(क) वाष्प-दाब परिवर्तन का प्रारम्भिक परिणाम क्या होगा?
(ख) प्रारम्भ में वाष्पन एवं संघनन की दर कैसे बदलती है?
(ग) क्या होगा, जबकि साम्य पुनः अन्तिम रूप से स्थापित हो जाएगा, तब अन्तिम वाष्प दाब क्या होगा?
उत्तर
(क) प्रारम्भ में वाष्प दाब घटेगा क्योंकि वाष्प का समान द्रव्यमान बढ़े आयतन में वितरित होता है।
(ख) बन्द पात्र में नियत ताप पर वाष्पन की दर नियत रहती है संघनन की दर प्रारम्भ में निम्न होगी।
(ग) अन्तिम रूप से स्थापित साम्य में संघनन की दर वाष्पन की देर के समान होती है। अन्तिम वाष्प दाब पहले के समान रहता है।
प्रश्न 2.
निम्नलिखित साम्य के लिए K, क्या होगा, यदि साम्य पर प्रत्येक पदार्थ की सान्द्रताएँ हैं– [SO2]⇌ 0.60 M, [O2] ⇌ 0.82 M एवं [SO3]⇌ 1.90 M
2SO2(g) +O2(g) ⇌ 2SO3(g)
उत्तर
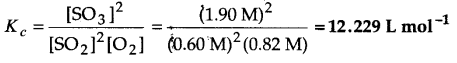
प्रश्न 3.
एक निश्चित ताप एवं कुल दाब 105 Pa पर आयोडीन वाष्प में आयतनानुसार 40% आयोडीन परमाणु होते हैं।
I2(g) ⇌ 2(g)
साम्य के लिए Kp की गणना कीजिए।
उत्तर

प्रश्न 4.
निम्नलिखित में से प्रत्येक अभिक्रिया के लिए साम्य स्थिरांक Kcको व्यंजक लिखिए-
(i) 2NOCl(g) ⇌ 2NO(g) + Cl2(g)
(ii) 2Cu(NO3)2(s) ⇌ 2CuO(s) + 4NO2(g) + O2(g)
(iii) CH3COOC2H5(g) + H2O(l) ⇌ CH2COOH(aq) + C2H5OH(aq)
(iv) Fe3+ (aq) + 3OH– (aq) ⇌ Fe(OH)3 (s)
(v) I2(s) + 5F2 ⇌ 2IF5
उत्तर


प्रश्न 5.
Kp के मान से निम्नलिखित में से प्रत्येक साम्य के लिए Kc का मान ज्ञात कीजिए-
(i) 2NOCI(g) ⇌ 2NO(g) + Cl2(g); K, ⇌ 1.8×10-2 at 500 K
(ii) CaCO3(s) ⇌ CaO(s) + CO2(g); K, ⇌ 167 at 1073 K
उत्तर

प्रश्न 6.
साम्य NO(g) +O3(g) ⇌NO2(g) +O2(g) के लिए 1000 K पर Kc ⇌ 6.3×1014 है। साम्य में अग्र एवं प्रतीप दोनों अभिक्रियाएँ प्राथमिक रूप से द्विअणुक हैं। प्रतीप अभिक्रिया के लिए Kc क्या है?
उत्तर

प्रश्न 7.
साम्य स्थिरांक का व्यंजक लिखते समय समझाइए कि शुद्ध द्रवों एवं ठोसों को उपेक्षित क्यों किया जा सकता है? मोलों की संख्या
उत्तर

शुद्ध ठोस या शुद्ध द्रव के आण्विक द्रव्यमान तथा घनत्व नियत ताप पर निश्चित होते हैं, अतः इनके मोलर सान्द्रण नियत होते हैं। यही कारण है कि इन्हें साम्य स्थिरांक के व्यंजक में उपेक्षित किया जा सकता है।
प्रश्न 8.
N2 एवं O2 के मध्य निम्नलिखित अभिक्रिया होती है
2N2(g) +O2(g) ⇌ 2N2O(g)
यदि एक 10L के पात्र में 0.482 मोल N, एवं 0.933 मोल O2, रखे जाएँ तथा एक ताप, जिस पर N20 बनने दिया जाए तो साम्य मिश्रण का संघटन ज्ञात कीजिए। Kc ⇌ 2.0×10-37|
उत्तर


प्रश्न 9.
निम्नलिखित अभिक्रिया के अनुसार नाइट्रिक ऑक्साइड Br2 से अभिक्रिया कर नाइट्रोसिल ब्रोमाइड बनाती है-
2NO(g) + Br2(g) ⇌ 2NOBr(g)
जब स्थिर ताप पर एक बन्द पात्र में 0.087 मोल NO एवं 0.0437 मोल Br2 मिश्रित किए जाते हैं, तब 0.0518 मोल NOBr प्राप्त होती है। NO एवं Br2 की साम्य मात्रा ज्ञात कीजिए।
उत्तर
0.0518 मोल NOBr का निर्माण 0.0518 मोल NO तथा 0.0518/2 ⇌ 0.0259 मोल Br2 से होता है।
अतः साम्य पर,
NO की मात्रा ⇌ 0.087-0.0518 ⇌ 0.0352 mol
Br2 की मात्रा ⇌ 0.0437-0.0259 ⇌ 0.0178 mol
प्रश्न 10.
साम्य 2SO2(g) +O2(g) ⇌ 2SO3(g) के लिए 450K पर Kp ⇌ 2.0×1010/bar है। इस ताप पर Kc का मान ज्ञात कीजिए।
उत्तर

प्रश्न 11.
HI(g) का एक नमूना 0.2 atm दाब पर एक फ्लास्क में रखा जाता है। साम्य पर HI(g) का आंशिक दाब 0.04 atm है। यहाँ दिए गए साम्य के लिए Kp का मान क्या होगा?
2HI(g) ⇌ H2(g) +I2(g)
उत्तर

प्रश्न 12.
500 K ताप पर एक 20L पात्र में N2 के 1.57 मोल, H2 के 1.92 मोल एवं NH3 के 8.13 मोल
का मिश्रण लिया जाता है। अभिक्रिया N2(g) +3H2(g) ⇌ 2NH3(g) के लिए Kc का मान 1.7×102 है। क्या अभिक्रिया-मिश्रण साम्य में है? यदि नहीं तो नेट अभिक्रिया की दिशा क्या होगी?
उत्तर

प्रश्न 13.
एक गैस अभिक्रिया के लिए

इस व्यंजक के लिए सन्तुलित रासायनिक समीकरण लिखिए।
उत्तर
4NO(g) +6H2O(g) ⇌ 4NH3 (g) +5O2(g)
प्रश्न 14.
H2O का एक मोल एवं CO का एक मोल 725 K ताप पर 10L के पात्र में लिए जाते हैं। साम्य पर 40% जल (भारात्मक) CO के साथ निम्नलिखित समीकरण के अनुसार अभिक्रिया करता है-
H2O(g) + CO(g) ⇌ H2(g) + CO2(g)
अभिक्रिया के लिए साम्य स्थिरांक की गणना कीजिए।
उत्तर

प्रश्न 15.
700 K ताप पर अभिक्रिया H2(g) +I2(g) ⇌ 2HI(g) के लिए साम्य स्थिरांक 54.8 है। यदि हमने शुरू में HI(g) लिया हो, 700 K ताप साम्य स्थापित हो तथा साम्य पर 0.5 mol L-1HI(g) उपस्थित हो तो साम्य पर H2(g) एवं I2(g) की सान्द्रताएँ क्या होंगी?
उत्तर

प्रश्न 16.
CI, जिसकी सान्द्रता प्रारम्भ में 0.78M है, को यदि साम्य पर आने दिया जाए तो प्रत्येक की साम्य पर सान्द्रताएँ क्या होंगी?
2ICI(g)⇌ I2(g)+ Cl2(g); Kc = 0.14
उत्तर

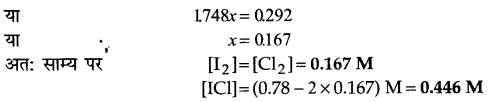
प्रश्न 17.
नीचे दर्शाए गए साम्य में 899K पर Kp का मान 0.04 atm है। C2H6 की साम्य पर सान्द्रता क्या होगी यदि 4.0 atm दाब पर C2H6 को एक फ्लास्क में रखा गया है एवं साम्यावस्था पर आने दिया जाता है?
C2H6(g) ⇌ C2H4(g) + H2(g)
उत्तर

प्रश्न 18.
एथेनॉल एवं ऐसीटिक अम्ल की अभिक्रिया से एथिलं ऐसीटेट बनाया जाता है एवं साम्य को इस प्रकार दर्शाया जा सकता है
CH3COOH (l)+C2H5H(l) ⇌ CH3COOC2H5(l) + H2O (l)
(i) इस अभिक्रिया के लिए सान्द्रता अनुपात (अभिक्रिया-भागफल) Qc लिखिए (टिप्पणी : यहाँ पर जल आधिक्य में नहीं है एवं विलायक भी नहीं है)
(ii) यदि 293 K पर 1.00 मोल ऐसीटिक अम्ल एवं 0.18 मोल एथेनॉल प्रारम्भ में लिए जाएँ तो अन्तिम साम्य मिश्रण में 0.171मोल एथिल ऐसीटेट है। साम्य स्थिरांक की गणना कीजिए।
(iii) 0.5 मोल एथेनॉल एवं 10 मोल ऐसीटिक अम्ल से प्रारम्भ करते हुए 293 K ताप पर कुछ । समय पश्चात् एथिल ऐसीटेट के 0.214 मोल पाए गए तो क्या साम्य स्थापित हो गया?
उत्तर


प्रश्न 19.
437K ताप पर निर्वात मैं PCI का एक नमूना एक फ्लास्क में लिया गया। साम्य स्थापित ‘ होने पर PCl5 की सान्द्रता 0.5×10-1molL-1 पाई गई, यदि Kc का मान 8.3×10-3 है तो साम्य पर PCl3 एवं Cl2 की सान्द्रताएँ क्या होंगी?
PCl5(g) ⇌ PCl3(g) + Cl2(g)
उत्तर

प्रश्न 20.
लौह अयस्क से स्टील बनाते समय जो अभिक्रिया होती है, वह आयरन (II) ऑक्साइड का कार्बन मोनोक्साइड के द्वारा अपचयन है एवं इससे धात्विक लौह एवं CO2 मिलते हैं।
FeO(s) + CO(g) ⇌ Fe(s) + CO2(g); Kp = 0.265 atm at 1050K
1050K पर CO एवं CO2 के साम्य पर आंशिक दाब क्या होंगे, यदि उनके प्रारम्भिक आंशिक दाब हैं-
PCO = 1.4 atm एवं pCO2= 0.80 atm.
उत्तर

प्रश्न 21.
अभिक्रिया N2(g)+3H2(g) ⇌ 2NH2(g) के लिए (500 K पर) साम्य स्थिरांक Kc= 0.061 है। एक विशेष समय पर मिश्रण का संघटन इस प्रकार है- 3.0 mol L-1N2, 2.0 mol L-1H2 एवं 0.5 mol L-1NH3 क्या अभिक्रिया साम्य में है? यदि नहीं तो साम्य स्थापित करने के लिए अभिक्रिया किस दिशा में अग्रसरित होगी?
उत्तर

प्रश्न 22.
ब्रोमीन मोनोक्लोराइड BrCI विघटित होकर ब्रोमीन एवं क्लोरीन देता है तथा साम्य स्थापित होता है-
2BrCI(g) ⇌ Be2(g)+Cl2(g) इसके लिए 500K पर Kc = 32 है। यदि प्रारम्भ में BrCI की सान्द्रता 3.3×10-3molL-1 हो तो साम्य पर मिश्रण में इसकी सान्द्रता क्या होगी?
उत्तर
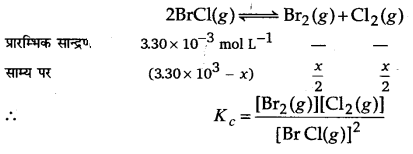

प्रश्न 23.
1127 K एवं 1 atm दाब पर CO तथा CO2 के गैसीय मिश्रण में साम्यावस्था पर ठोस कार्बन में 90.55% (भारात्मक) CO है।
C(s)+CO2(g) ⇌ 42CO(g)
उपर्युक्त ताप पर अभिक्रिया के लिए Kc के मान की गणना कीजिए।
उत्तर

प्रश्न 24.
298K पर NO एवं O2 से NO2 बनती है-
NO(g) +O2(g) ⇌ NO2(g)
अभिक्रिया के लिए (क) ∆G⊖ एवं (ख) साम्य स्थिरांक की गणना कीजिए-
∆fG⊖ (NO2)= 52.0 kJ/mol
∆fG⊖ (NO) = 87.0 kJ/mol
∆fG⊖ (O2) = 0 kJ/mol
उत्तर

प्रश्न 25.
निम्नलिखित में से प्रत्येक साम्य में जब आयतन बढ़ाकर दाब कम किया जाता है, तब बतलाइए कि अभिक्रिया के उत्पादों के मोलों की संख्या बढ़ती है या घटती है या समान रहती है?
(क) PCl2(g) ⇌ PCl3(g) + Cl2(g)
(ख) CaO(s) + CO2(g) ⇌ CaCO3(s)
(ग) 3Fe(s) + 4H2O(g) ⇌ Fe3O4(s) + 4H2(g)
उत्तर
लोशातेलिए सिद्धान्त के अनुसार दाब कम करने पर उत्पादों के मोलों की संख्या
(क) बढ़ेगी,
(ख) घटेगी,
(ग) समान रहेगी।
प्रश्न 26.
निम्नलिखित में से दाब बढ़ाने पर कौन-कौन सी अभिक्रियाएँ प्रभावित होंगी? यह भी बताएँ कि दाब परिवर्तन करने पर अभिक्रिया अग्र या प्रतीप दिशा में गतिमान होगी?
(i) COCl2(g) ⇌ CO(g);+ Cl2(g)
(ii) CH4(g) + 2S2(g) ⇌ CS2(g) + 2H2S(g)
(iii) CO2(g) + C(s) ⇌ 2C0(g)
(iv) 2H2(g) + CO(g) ⇌ CH3OH(g)
(v) CaCO3(s) ⇌ CaO(s) + CO2(g)
(vi) 4NH3(g) + 5O2(g) ⇌ 4NO(g) + 6H2O(g)
उत्तर
वे अभिक्रियाएँ प्रभावित होंगी जिनमें (n, #n,) हो। अत: अभिक्रियाएँ (i), (iii), (iv), (v) तथा (vi) प्रभावित होंगी। ला-शातेलिए सिद्धान्त के अनुसार हम अभिक्रियाओं की दिशा प्रागुप्त कर सकते हैं।
- np = 2, nr = 1 अर्थात् np > nr, अतः अभिक्रिया पश्चे दिशा में होगी।
- np = 3, nr = 3 अर्थात् np = nr, अतः अभिक्रिया दाब से प्रभावित नहीं होगी।
- np = 2, nr = 1 अर्थात् np >nr, अतः अभिक्रिया पश्च दिशा में होगी।
- np = 1, nr = 3 अर्थात् np <nr, अत: अभिक्रिया अग्र दिशा में होगी।
- np = 1, nr = 0 अर्थात् np > nr, अत: अभिक्रिया पश्च दिशा में होगी।
- np = 10, nr = 9 अर्थात् np >nr, अतः अभिक्रिया पश्च दिशा में होगी।
प्रश्न 27.
निम्नलिखित अभिक्रिया के लिए 1024 K पर साम्य स्थिरांक 1.6 x 105 है।
H2(g)+ Br2(g) ⇌ 2HBr(g)
यदि HBr के 10.0 bar सीलयुक्त पात्र में डाले जाएँ तो सभी गैसों के 1024 K पर साम्य दाब ज्ञात कीजिए।
उत्तर
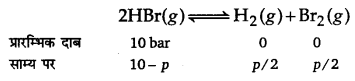

प्रश्न 28.
निम्नलिखित ऊष्माशोषी अभिक्रिया के अनुसार ऑक्सीकरण द्वारा डाइहाइड्रोजन गैस | प्राकृतिक गैस से प्राप्त की जाती है-
CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g)
(क) उपर्युक्त अभिक्रिया के लिए Kp का व्यंजक लिखिए।
(ख) Kp एवं अभिक्रिया मिश्रण का साम्य पर संघटन किस प्रकार प्रभावित होगा, यदि?
(i) दाब बढ़ा दिया जाए।
(ii) ताप बढ़ा दिया जाए।
(iii) उत्प्रेरक प्रयुक्त किया जाए।
उत्तर

(ख)
- ला-शातेलिए सिद्धान्त के अनुसार साम्य पश्च दिशा में विस्थापित होगा।
- चूँकि दी गयी अभिक्रिया ऊष्माशोषी है, अत: साम्य अग्र दिशा में विस्थापित होगा।
- साम्यावस्था भंग नहीं होगी लेकिन साम्यावस्था शीघ्र प्राप्त होगी।
प्रश्न 29.
साम्य 2H2(g) + CO(g) ⇌ CH2OH(g) पर प्रभाव बताइए|
(क) H2 मिलाने पर
(ख) CH3OH मिलाने पर
(ग) CO हटाने पर
(घ) CH3OH हटाने पर।
उत्तर
ला-शातेलिए सिद्धान्त के अनुसार,
(क) साम्यावस्था अग्र दिशा में विस्थापित होगी।
(ख) साम्यावस्था पश्च दिशा में विस्थापित होगी।
(ग) साम्यावस्था पश्च दिशा में विस्थापित होगी।
(घ) साम्यावस्था अग्र दिशा में विस्थापित होगी।
प्रश्न 30.
473 K पर फॉस्फोरस पेंटाक्लोराइड PCls के विघटन के लिए K. का मान 8.3×10-3 है। यदि विघटन इस प्रकार दर्शाया जाए तो
PCl2(g) ⇌ PCl3(g) + Cl2(g); ∆rH⊖ = 124.0 kJ mol-1
(क) अभिक्रिया के लिए Kc क़ा व्यंजक लिखिए।
(ख) प्रतीप अभिक्रिया के लिए समान ताप पर Kc का मान क्या होगा?
(ग) यदि
(i) और अधिक PCl5 मिलाया जाए,
(ii) दाब बढ़ाया जाए तथा
(iii) ताप बढ़ाया जाए तो Kc पर क्या प्रभाव होगा?
उत्तर
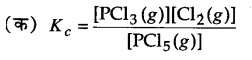

प्रश्न 31.
हेबर विधि में प्रयुक्त हाइड्रोजन को प्राकृतिक गैस से प्राप्त मेथेन को उच्च ताप की भाप से क्रिया कर बनाया जाता है। दो पदों वाली अभिक्रिया में प्रथम पद में CO एवं H2 बनती हैं। दूसरे पद में प्रथम पद में बनने वाली CO और अधिक भाप से अभिक्रिया करती है।
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
यदि 400°C पर अभिक्रिया पात्र में co एवं भाप का सममोलर मिश्रण इस प्रकार लिया जाए कि pCO = PH2O = 4.0 bar, H2 का साम्यावस्था पर आंशिक दाब क्या होगा? 400°C पर Kp = 10.1
उत्तर

प्रश्न 32.
बताइए कि निम्नलिखित में से किस अभिक्रिया में अभिकारकों एवं उत्पादों की सान्द्रता सुप्रेक्ष्य होगी-
(क) Cl2(g) ⇌ 2Cl(g) Kc=5×10-39
(ख) Cl2(g) + 2NO(g) ⇌ 2NOCI(g) Kc = 3.7×108
(ग) Cl2(g) + 2NO2(g) ⇌ 2NO2Cl(g) Kc = 1.8
उत्तर
अभिक्रिया (ग) जिसके लिए Kन उच्च और न निम्न में अभिकारकों तथा उत्पादों की सान्द्रता सुप्रेक्ष्य होगी।
प्रश्न 33.
25°C पर अभिक्रिया 3O2(g)⇌ 2O3 (g) के लिए K. का मान 2.0 x 10-50है। यदि वायु में 25°C ताप पर O2 की साम्यावस्था सान्द्रता 1.6 x 10-2 है तो की सान्द्रता क्या होगी?
उत्तर

प्रश्न 34.
Co(g) +3H2(g)⇌CH4(g) + H2O(g) अभिक्रिया एक लीटर फ्लास्क में 1300 K पर साम्यावस्था में है। इसमें CO के 0.3 मोल, H2 के 0.01 मोल, H2O के 0.02 मोल एवं CH4 की अज्ञात मात्रा है। दिए गए ताप पर अभिक्रिया के लिए Kc का मान 3.90 है। मिश्रण CH4 की मात्रा ज्ञात कीजिए।
उत्तर

प्रश्न 35.
संयुग्मी अम्ल-क्षारक युग्म का क्या अर्थ है? निम्नलिखित स्पीशीज के लिए संयुग्मी अम्ल/क्षारक बताइए- HNO2, CN–, HClO4, F–, OH–,CO2-3 एवं S2-
उत्तर
संयुग्मी अम्ल-क्षार युग्म (Conjugate acid-base pair)-अम्ल-क्षार युग्म जिसमें एक प्रोटॉन का अंतर होता है, संयुग्मी अम्ल-क्षार युग्म कहलाता है। अम्ल-HNO2,HClO4
क्षारक- CN–, F–, OH–, CO2-3 एवं S2-
इनके संयुग्मी अम्ल/क्षारक निम्नलिखित हैं-

प्रश्न 36.
निम्नलिखित में से कौन-से लूइस अल ही
H2O, BF3, H+ एवं NH4+
उत्तर
BF3, H+ तथा NH4+.
प्रश्न 37.
निम्नलिखित ब्रान्स्टेड अम्लों के लिए संयुग्मकों कैमून लिखिए-
HF, H2SO4 एवं HCO3–
उत्तर
F–,HSO4– तथा CO2-3
(संयुग्मी क्षारक ⇌ संयुग्मी अम्ल –H+)
प्रश्न 38.
ब्रान्स्टेड क्षारकों NH2–, NH2 तथा HCOO– के संयुग्मी अम्ल लिखिए
उत्तर
NH3, NH+4, HCOOH
(संयुग्मी अम्ल ⇌ संयुग्मी क्षारक +H+)
प्रश्न 39.
स्पीशीज H2O, HCO2–, HSO4– ता NH2 ब्राम्स्टेड अम्ल तथा क्षारक-दोनों की भाँति व्यवहार करते हैं। प्रत्येक के संयुग्मी अम्ल लथा-क्षकबाइए।
उत्तर

प्रश्न 40.
निम्नलिखित स्पीशीज को लूइस अम्ल तथा क्षारक में वर्गीकृत कीजिए तथा बताइए कि ये किस प्रकार लूइस अम्ल-क्षारक के समान कार्य करते हैं—
(क) OH–
(ख) F–
(ग) H+
(घ) BCl3
उत्तर
(क) OH– इलेक्ट्रॉन युग्म दान कर सकता है, अतः यह लुइस क्षारक है।
(ख) F– इलेक्ट्रॉन युग्म दान कर सकता है, अतः यह लुइस क्षारक है।
(ग) H+ इलेक्ट्रॉन युग्म ग्रहण कर सकता है, अतः यह लुइस अम्ले है।
(घ) BCl3 इलेक्ट्रॉन न्यून स्पीशीज है, अतः यह लुइस अम्ल है।
प्रश्न 41.
एक मृदु पेय के नमूने में हाइड्रोजन आयन की सान्द्रता 3.8 x 10-3 M है। उसकी pH परिकलित कीजिए।
उत्तर
![]()
pH=-log[H+]=-log(3.8×10-3)= 2.42
प्रश्न 42.
सिरके के नमूने की pH 3.76 है, इसमें हाइड्रोजन आयन की सान्द्रता ज्ञात कीजिए।
उत्तर
∴ log [H+]=-3.76
या [H+] = antilog (-3.76) = antilog 4.24 = 1.74×10-4 M
प्रश्न 43.
HF, HCOOH तथा HCN का 298K पर आयनन स्थिरांक क्रमशः 6.8 x 10-4, 1.8 x 10-4 तथा 4.8 x 10-9 है। इनके संगत संयुग्मी क्षारकों के आयनन स्थिरांक ज्ञात कीजिए।
उत्तर

प्रश्न 44.
फीनॉल का आयनन स्थिरांक 1.0 x 10-10 है। 0.05 M फीनॉल के विलयन में फीनॉलेट आयन की सान्द्रता तथा 0.01 M सोडियम फीनेट विलयन में उसके आयनन की मात्रा ज्ञात कीजिए।
उत्तर



प्रश्न 45.
H2S का प्रथम आयनन स्थिरांक 9.1×10-8 है। इसके 0:1 M विलयन में HS– आयनों की सान्द्रता की गणना कीजिए तथा बताइए कि यदि इसमें 0.1 M HCl भी उपस्थित हो तो | सान्द्रता किस प्रकार प्रभावित होगी? यदि H2S का द्वितीय वियोजन स्थिरांक 1.2×10-13 हो तो सल्फाइड S2- आयनों की दोनों स्थितियों में सान्द्रता की गणना कीजिए।
उत्तर
प्रथम परिस्थिति के अनुसार,



प्रश्न 46.
ऐसीटिक अम्ल का आयनन स्थिरांक 1.74 x10-5 है। इसके 0.05 M विलयन में वियोजन की मात्रा, ऐसीटेट आयन सान्द्रता तथा pH का परिकलन कीजिए।
उत्तर

प्रश्न 47.
0.01 M कार्बनिक अम्ल [HA] के विलयन की pH, 4.15 है। इसके ऋणायन की सान्द्रता, अम्ल का आयनन स्थिरांक तथा pKa, मान परिकलित कीजिए।
उत्तर

प्रश्न 48.
पूर्ण वियोजन मानते हुए निम्नलिखित विलयनों के pH ज्ञात कीजिए
(क) 0.003 M HCI
(ख) 0.005 M NaOH
(ग) 0.002 M HBr
(घ) 0.002 M KOH
उत्तर

प्रश्न 49.
निम्नलिखित विलयनों के pH ज्ञात कीजिए–
(क) 2 ग्राम TIOH को जल में घोलकर 2 लीटर विलयन बनाया जाए।
(ख) 0.3 ग्राम Ca(OH)2 को ज़ल में घोलकर 500 mL विलयन बनाया जाए।
(ग) 0:3 ग्राम NaOH को जल में घोलकर 200 mL विलयन बनाया जाए।
(घ) 13.6 MHCI के 1 mL को जल से तनुकरण करके कुल आयतन 1 लीटर किया जाए।
उत्तर


प्रश्न 50.
ब्रोमोऐसीटिक अम्ल की आयनन की मात्रा 0.132 है। 0.1 M अम्ल की pH तथा pKa का मान ज्ञात कीजिए।
उत्तर

प्रश्न 51.
0.005 M कोडीन (C18H21NO3) विलयन की pH 9.95 है। इसका आयनन स्थिरांक ज्ञात कीजिए।
उत्तर


प्रश्न 52.
0.001 M ऐनिलीन विलयन का pH क्या है? ऐनिलीन का आयनन स्थिरांक 4.27×10-10 है। इसके संयुग्मी अम्ल का आयनन स्थिरांक ज्ञात कीजिए।
उत्तर


प्रश्न 53.
यदि 0.05 M ऐसीटिक अम्ल के pKa का मान 4.74 है तो आयनने की मात्रा ज्ञात कीजिए। यदि इसे
(अ) 0.01 M
(ब) 0.1 M HCI विलयन में डाला जाए तो वियोजन की मात्रा किस प्रकार प्रभावित होती है?
उत्तर
![]()


प्रश्न 54.
डाइमेथिल ऐमीन का आयनन स्थिरांक 5.4×10-4 है। इसके 0.02 M विलयन की आयनन की मात्रा की गणना कीजिए। यदि यह विलयन NaOH प्रति 0.1 M हो तो डाइमेथिल ऐमीन का प्रतिशत आयनन क्या होगा?
उत्तर


प्रश्न 55.
निम्नलिखित जैविक द्रवों, जिनमें pH दी गई है, की हाइड्रोजन आयन सान्द्रता परिकलित कीजिए-
(क) मानव पेशीय द्रव, 6.83
(ख) मानव उदर द्रव, 1.2
(ग) मानव रुधिर, 7.38
(घ) मानव लार, 6.4
उत्तर

प्रश्न 56.
दूध, कॉफी, टमाटर रस, नींबू रस तथा अण्डे की सफेदी के pH का मान क्रमशः 6.8, 5.0, 4.2, 2.2 तथा 7.8 हैं। प्रत्येक के संगत H+ आयन की सान्द्रता ज्ञात कीजिए।
उत्तर

प्रश्न 57.
298 K पर 0.561 g, KOH जल में घोलने पर प्राप्त 200 mL विलयन की pH तथा पोटैशियम, हाइड्रोजन तथा हाइड्रॉक्सिल आयनों की सान्द्रताएँ ज्ञात कीजिए।
उत्तर

प्रश्न 58.
298 K पर Sr(OH)2 विलयन की विलेयता 19.23 g/L है। स्ट्रांशियम तथा हाइड्रॉक्सिल आयन की सान्द्रता तथा विलयन की pH ज्ञात कीजिए।
उत्तर

प्रश्न 59.
प्रोपेनोइक अम्ल का आयनन स्थिरांक 1.32 x 10-5 है। 0.05 M अम्ल विलयन के आयनन की मात्रा तथा pH ज्ञात कीजिए। यदि विलयन में 0.01 MHCI मिलाया जाए तो उसके आयनन की मात्रा ज्ञात कीजिए।
उत्तर

प्रश्न 60.
यदि सायनिक अम्ल (HCNO) के 0.1 M विलयन की pH 2.34 हो तो अम्ल के आयनन स्थिरांक तथा आयनन की मात्रा ज्ञात कीजिए।
उत्तर

प्रश्न 61.
यदि नाइट्रस अम्ल का आयनन स्थिरांक 4.5×10-4 है तो 0.04 M सोडियम नाइट्राइट विलयन की pH तथा जलयोजन की मात्रा ज्ञात कीजिए।
उत्तर

प्रश्न 62.
यदि पिरीडिनीयम हाइड्रोजन क्लोराइड के 0.02 M विलयन का pH 3.44 है तो पिरीडीन का आयनन स्थिरांक ज्ञात कीजिए।
उत्तर

प्रश्न 63.
निम्नलिखित लवणों के जलीय विलयनों के उदासीन, अम्लीय तथा क्षारीय होने की प्रागुक्ति कीजिए
NaCI, KBr, NaCN, NH4NO3, NaNO2 तथा KF
उत्तर
NaCN, NaNO2, KF विलयन क्षारीय प्रकृति के होते हैं क्योंकि ये प्रबल क्षारक तथा दुर्बल अम्ल के लवण होते हैं। NaCl, KBr विलयन उदासीन प्रकृति के होते हैं क्योंकि ये प्रबल अम्ल तथा प्रबल क्षारक के लवण होते हैं। NH4NO3 विलयन अम्लीय प्रकृति का होता है क्योंकि यह प्रबल अम्ल तथा दुर्बल क्षारक को लवण होता है।
प्रश्न 64.
क्लोरोऐसीटिक अम्ल का आयनन स्थिरांक 1.35×10-3 है। 0.1 M अम्ल तथा इसके 0.1 M सोडियम लवण की pH ज्ञात कीजिए।
उत्तर


प्रश्न 65.
310 K पर जल का आयनिक गुणनफल 2.7×10-14 है। इसी तापक्रम पर उदासीन जल की pH ज्ञात कीजिए।
उत्तर

प्रश्न 66.
निम्नलिखित मिश्रणों की pH परिकलित कीजिए-
(क) 0.2 M Ca(OH)2 का 10 mL + 0.1 M HCI का 25 mL
(ख) 0.01 M H2SO4 का 10 mL+ 0.01 M Ca(OH)2 का 10 mL
(ग) 0.1 MH2SO4 का 10 mL + 0.1 M KOH का 10.mL
उत्तर


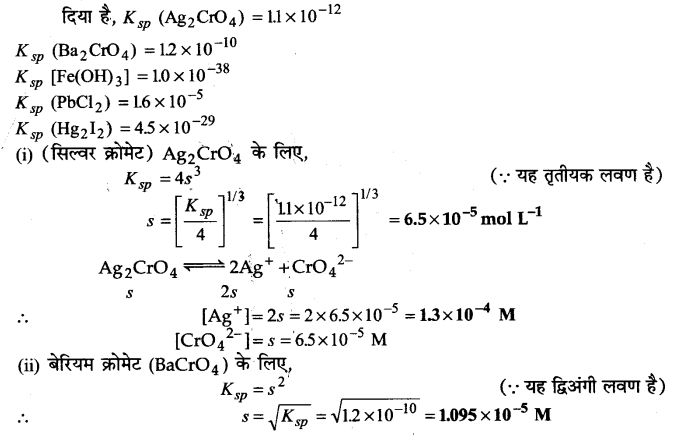
प्रश्न 67.
सिल्वर क्रोमेट, बेरियम क्रोमेट, फेरिक हाइड्रॉक्साइड, लेड क्लोराइड तथा मयूरस आयोडाइड विलयन के 298 K पर निम्नलिखित दिए गए विलेयता गुणनफल स्थिरांक की सहायता से विलेयता ज्ञात कीजिए तथा प्रत्येक आयन की मोलरता भी ज्ञात कीजिए।
उत्तर


प्रश्न 68.
Ag2CrO4 तथा AgBr का विलेयता गुणनफल स्थिरांक क्रमशः 1.1 x 10-12तथा 5.0×10-13 हैं। उनके संतृप्त विलयन की मोलरता का अनुपात ज्ञात कीजिए।
उत्तर

प्रश्न 69.
यदि 0-002 M सान्द्रता वाले सोडियम आयोडेट तथा क्यूप्रिंक क्लोरेट विलयन के समान आयतन को मिलाया जाए तो क्या कॉपर आयोडेट का अवक्षेपण होगा? (कॉपर आयोडेट के लिए Ksp = 7.4×10-8)
उत्तर

प्रश्न 70.
बेन्जोइक अम्ल का आयनन स्थिरांक 6.46 x 10-5 तथा सिल्वर बेन्जोएट का Ksp 2.5×10-13 है। 3.19 pH वाले बफर विलयन में सिल्वर बेन्जोएट जल की तुलना में कितना गुना विलेय होगा?
उत्तर


प्रश्न 71.
फेरस सल्फेट तथा सोडियम सल्फाइड के सममोलर विलयनों की अधिकतम सान्द्रता बताइए जब उनके समान आयतन मिलाने पर आयरन सल्फाइड अवक्षेपित न हो।
(आयरन सल्फाइड के लिए Ksp = 6.3×10-18)।
उत्तर

प्रश्न 72.
1 ग्राम कैल्सियम सल्फेट को घोलने के लिए कम से कम कितने आयतन जल की आवश्यकता होगी? (कैल्सियम सल्फेट के लिए Ksp = 9.1×10-6)
उत्तर


प्रश्न 73.
0.1 MHCI में हाइड्रोजन सल्फाइड से संतृप्त विलयन की सान्द्रता 1.0×10-19 M है। यदि इस विलयन का 10 mL निम्नलिखित 0.04 M विलयन के 5 mL में डाला जाए तो किन विलयनों से अवक्षेप प्राप्त होगा? FeSO4, MnCl2, ZnCl2 एवं CaCl2
उत्तर

परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
वह साम्यावस्था जिस पर दाब बदलने का कोई प्रभाव नहीं होता है, है
(i) N2(g)+O2(g) ⇌2NO(g)
(ii) 2SO2(g)+O2(g) ⇌ 2SO3(g)
(iii) 2O3(g)⇌ 3O2(g)
(iv) 2NO2(g)⇌ N2O4(g)
उत्तर
(i) N2(g)+O2(g) ⇌ 2NO(g)
प्रश्न 2.
एक उत्क्रमणीय अभिक्रिया का उदाहरण है।
(i) AgNO3 + HCl ⇌ AgCl + HNO3
(ii) HgCl2 + H2S ⇌ Hgs + 2HCl
(iii) KNO3 + NaCl ⇌ KCl + NaNO3
(iv) 2Na + 2H2O ⇌2NaOH + H2
उत्तर
(iii) KNO3 + NaCl ⇌ KCl + NaNO3
प्रश्न 3.
अभिक्रिया H2(g) + I2(g) ⇌2HI(g) में H2, I2 व HI के साम्यावस्था में मोलर सान्द्रण क्रमशः 0.2 मोल प्रति लीटर, 0.3 मोल प्रति लीटर तथा 0.6 मोल प्रति लीटर हैं। साम्य स्थिरांक Kc का मान है।
(i) 1
(ii) 6
(iii) 2
(iv) 3
उत्तर

प्रश्न 4.
निकाय 2A (g) + B(g) ⇌ 3C(g) के लिए साम्य स्थिरांक Kc बराबर होगा

उत्तर
(iv)
प्रश्न 5.
यदि अभिक्रिया H2(g) + I2(g) ⇌ 2HI(g) के लिए Kc का मान 50 है तो अभिक्रिया 2HI(g) ⇌ H2(g) + I2(g) के लिए Kc का मान होगा
(i) 20.0
(ii)
(iii) 50
(iv) 5.0
उत्तर
(i)
प्रश्न 6.
एक उत्क्रमणीय अभिक्रिया में दो पदार्थ साम्य में हैं। यदि प्रत्येक पदार्थ का सान्द्रण दोगुना कर दिया जाए, तो साम्य स्थिरांक होगा
(i) स्थिर
(ii) पहले के मान का आधा
(iii) पहले के मान का चौथाई
(iv) दोगुना
उत्तर
(i) स्थिर
प्रश्न 7.
समांगी अभिक्रिया 4NH3 + 5O2 ⇌ 4NO + 6H2O के लिए Kc की इकाई है।
(i) सान्द्रता
(ii) सान्द्रता+1
(iii) सान्द्रता-1
(iv) यह विमारहित है।
उत्तर
(ii) सान्द्रता+1
प्रश्न 8.
अभिक्रिया के लिए किसी ताप पर साम्य स्थिरांक का मान 0.2 मोल-1 लीटर है। उसी ताप पर अभिक्रिया
के लिए साम्य स्थिरांक का मान है।
(i) 10
(ii) 5
(iii) 25
(iv) 50
उत्तर
(iii) 25
प्रश्न 9.
स्थिर दाब पर साम्य मिश्रण में अक्रिय गैस मिलानेपर में x का मान हो जाएगा
(i) अपरिवर्तित
(ii) अधिक
(iii) कम
(iv) शून्य
उत्तर
(ii) अधिक
प्रश्न 10.
साम्य स्थिरांक Kc की यूनिट अभिक्रिया N2(g) + 3H2(g) ⇌2NH3(g) के लिए होगी
(i) लीटर2 मोल-2
(ii) लीटर मोल-2
(iii) लीटर मोल-1
(iv) मोल लीटर-1
उत्तर
(i) लीटर2 मोल-2
प्रश्न 11.
एक जलीय विलयन में निम्नलिखित साम्य है।
CH2COOH ⇌ CH2COO– + H+ यदि इस विलयन में तनु HCI अम्ल मिलाया जाता है, तो
(i) साम्य स्थिरांक बढ़ जायेगा
(ii) साम्य स्थिरांक घट जायेगा
(iii) ऐसीटेट आयन की सान्द्रता घट जायेगी
(iv) ऐसीटेट आयन की सान्द्रता बढ़ जायेगी
उत्तर
(iii) ऐसीटेट आयन की सान्द्रता घट जायेगी।
प्रश्न 12.
अभिक्रिया 2NH3 ⇌ N2 + 3H2 के लिए किसी ताप पर साम्य स्थिरांक (Kc) का
मान K1 है। इसी ताप पर अभिक्रिया के लिए साम्य स्थिरांक (Kc) का मान K2 है। साम्य स्थिरांक K1 तथा K2 के सम्बन्ध का सही समीकरण है।

उत्तर
(iv)
प्रश्न 13.
अभिक्रिया 2SO3 ⇌ 2SO2 + O2 के लिए साम्य स्थिरांक Kp तथा Kc के मात्रक क्रमशः हैं।
(i) कोई नहीं, मील2-लीटर-2
(ii) वायुमण्डल, मोल-लीटर-2
(iii) वायुमण्डल, कोई नहीं
(iv) वायुमण्डल, मोल-लीटर-1
उत्तर
(iv) वायुमण्डल, मोल-लीट-1
प्रश्न 14.
ला-शातेलिए का नियम निम्न में से किसके लिए लागू नहीं होता है ?
(i) H2(g)+I2(g) ⇌2HI(g)
(ii) 2SO2(g)+O2(g) ⇌ 2SO3(g)
(iii) N2(g)+3H2(g)⇌⇌ 2NH3(g)
(iv) Fe(s)+S(s) ⇌ FeS(s)
उत्तर
(iv) Fe(s)+S(s) ⇌ FeS(s)
प्रश्न 15.
0.001N H2SO4 विलयन का pH मान होगा
(i) 5
(ii) 2
(iii) 3
(iv) 11
उत्तर
(iii) 3
प्रश्न 16.
यदि किसी जलीय विलयन के pH का मान शून्य हो, तो वह विलयन होगा
(i) अम्लीय
(ii) क्षारीय
(iii) उदासीन
(iv) इनमें से कोई नहीं
उत्तर
(i) अम्लीय
प्रश्न 17.
लवण जिसके नॉर्मल जलीय विलयन के pH मान की सर्वाधिक होने की सम्भावना है, वह है।
(i) CH3COONH4
(ii) NH2Cl
(iii) NaCN
(iv) KCl
उत्तर
(iii) NaCN
प्रश्न 18.
निम्नलिखित में से किस जलीय विलयन का pH मान सबसे कम है?
(i) NaOH
(ii) NaCl
(iii) NH4Cl
(iv) NH4OH
उत्तर
(iii) NH4Cl
प्रश्न 19.
ऐसीटिक अम्ल 50% वियोजित होता है। 0.0002 N ऐसीटिक अम्ल का pH मान है।
(i) 3.6
(ii) 4
(iii) 3
(iv) 3.4
उत्तर
(i) 4
प्रश्न 20.
एक जलीय विलयन का pH4 है। विलयन में हाइड्रोजन आयनों की सान्द्रता होगी
(i) 10-2 मोल/लीटर
(ii) 10-4 मोल/लीटर
(iii) 10-6 मोल/लीटर
(iv) 10-8 मोल/लीटर
उत्तर
(ii) 10-4 मोल/लीटर
प्रश्न 21.
HCI विलयन का pH होगा
(i) 3
(ii) 6
(iii) 9
(iv) 12
उत्तर
(i) 3
प्रश्न 22.
AgCI की विलेयता NaCI विलयन में जल की अपेक्षा कम होने का कारण है।
(i) लवण प्रभाव
(ii) सम-आयन प्रभाव
(iii) विलेयता गुणनफुल का कम होना।
(iv) जटिल यौगिक का बनना
उत्तर
(ii) सम-आयन प्रभाव
प्रश्न 23.
निम्नलिखित में से किस प्रतिरोधक (बफर) विलयन का pH मान 7 से अधिक होगा?
(i) CH3COOH+CH2COONa
(ii) NH4OH+ NH4Cl
(iii) HCOOH + HCOOK
(iv) HCN+ KCN
उत्तर
(ii) NH4OH+NH4Cl
प्रश्न 24.
निम्नलिखित में से कौन-सा उभय प्रतिरोधी (बफर) विलयन है?
(i) KOH+ HCl ।
(ii) HNO3 +NaNO3
(iii) HCOOH + HCOONa
(iv) HCl + NaCl
उत्तर
(iii) HCOOH + HCOONa
प्रश्न 25.
निम्नलिखित में से कौन-सा प्रतिरोधक (बफर) विलयन है?
(i) KOH + KCl
(ii) HNO3 + KNO3
(iii) NH4Cl + NH4OH
(iv) HCl + NaCl
उत्तर
(iii) NH4Cl + NH4OH
प्रश्न 26.
Ag2CrO4, के संतृप्त विलयन में CrO42- की सान्द्रता 1.0×10-4 मोल/लीटर है। इसके विलेयता गुणनफल का मान होगा
(i) 10×10-8
(ii) 10×10-12
(iii) 4.0×10-8
(iv) 4.0×10-12
उत्तर
(iv) 4.0×10-12
प्रश्न 27.
लवण AB2के संतृप्त विलयन में [B–] की सान्द्रता x मोल/लीटर है। लवण के विलेयता गुणनफल का मान है।

उत्तर
(i)
प्रश्न 28.
20°C पर AgCI की विलेयता 1×10-5मोल/लीटर है। AgCI का विलेयता गुणनफल होगा
(i) 10-10
(ii) 1.435×10-3
(iii) 2×10-5
(iv) इनमें से कोई नहीं
उत्तर
(i) 10-10
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
रासायनिक साम्यावस्था किसे कहते हैं? इसके मुख्य लक्षण क्या हैं?
उत्तर
किसी उत्क्रमणीय अभिक्रिया की वह अवस्था जिसमें अभिकारक तथा उत्पाद पदार्थों का सान्द्रण अपरिवर्तित रहता है, रासायनिक साम्यावस्था कहलाती है। अभिक्रिया की साम्यावस्था पर अभिकारकों से जिस मात्रा में उत्पाद बनते हैं, उसी मात्रा के समतुल्य उत्पाद से अभिकारक भी बनते
रासायनिक साम्य के प्रमुख लक्षण निम्नलिखित हैं।
- केवल उत्क्रमणीय अभिक्रियाएँ साम्यावस्था प्राप्त करती हैं।
- अग्र तथा विपरीत अभिक्रियाओं का वेग समान तथा विपरीत होता है।
- दोनों अभिक्रियाएँ पूर्णरूपं से होती हैं।
- अभिकारक तथा उत्पाद की मात्राएँ मिश्रण में स्थिर रहती हैं।
- दाब, ताप या सान्द्रण के परिवर्तन से साम्यावस्था में परिवर्तन हो जाता है।
प्रश्न 2.
पदार्थ के सक्रिय द्रव्यमान की परिभाषा दीजिए। यह किस प्रकारे व्यक्त किया जाता है ?
उत्तर
किसी पदार्थ का सक्रिय द्रव्यमान उस पदार्थ की आण्विक सान्द्रता को कहते हैं। दूसरे शब्दों में, किसी पदार्थ के मात्रक आयतन में उपस्थित ग्राम अणुक मात्रा को पदार्थ का सक्रिय द्रव्यमान कहते हैं। इसे कोष्ठक [ ] से व्यक्त किया जाता है। पदार्थ A के सक्रिय द्रव्यमान को निम्न प्रकार व्यक्त करते हैं।

प्रश्न 3.
250 मिली विलयन में 4.6 ग्राम एथेनॉल घुला है। इसके सक्रिय द्रव्यमान की गणना कीजिए।
उत्तर

प्रश्न 4.
साम्य स्थिरांक को परिभाषित कीजिए।
उत्तर
स्थिर ताप पर, किसी उत्क्रमणीय अभिक्रिया की अग्र और विपरीत अभिक्रियाओं के वेग स्थिरांकों के अनुपात को अभिक्रिया का साम्य स्थिरांक कहते हैं।
प्रश्न 5.
अभिक्रिया m1A+m2B ⇌ n1C + n2D के लिए साम्य स्थिरांक Kc का मान स्थापित कीजिए।
उत्तर

प्रश्न 6.
यदि अभिक्रिया A2 + B2⇌2AB के लिए साम्य स्थिरांक K1 हो तथा अभिक्रिया , के लिए साम्य स्थिरांक K2 हो, तो K1 तथा K2 में सम्बन्ध स्थापित कीजिए।
उत्तर
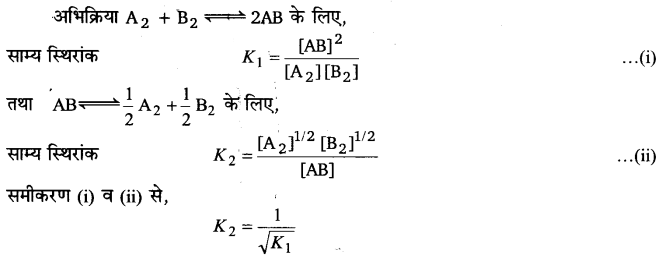
प्रश्न 7.
अभिक्रिया 2NH3 ⇌ N2+3H2 के साम्य स्थिरांक को मात्रक ज्ञात कीजिए।
उत्तर
इस अभिक्रिया का साम्य स्थिरांक व्यंजक है,

प्रश्न 8.
400° सेग्रे पर किसी दो लीटर वाले अभिक्रिया पात्र में 4.0 ग्राम हाइड्रोजन तथा 128.0 ग्राम हाइड्रोजन आयोडाइड (HI) लिए गये हैं। इनके सक्रिय द्रव्यमान की गणना कीजिए। (H = 1,I = 127)
उत्तर
HI का अणुभार = 1+127 = 128

प्रश्न 9.
अभिक्रिया aA +BB ⇌ cC + dD का साम्य स्थिरांक, K = 5.0×103 है। अभिक्रिया cC + aD ⇌ aA + bB के साम्य स्थिरांक, K’ की गणना कीजिए।
उत्तर

प्रश्न 10.
अभिक्रिया 2NO2(g) ⇌ 2NO(g) +O2(g) के लिए K. का मान 1.8 x 10-6है। अभिक्रिया के लिए K’c का मान ज्ञात कीजिए।
उत्तर

प्रश्न 11.
निम्नलिखित अभिक्रिया में साम्यावस्था पर मिश्रण में 3.0 ग्राम हाइड्रोजन, 2.54 ग्राम आयोडीन तथा 128.0 ग्राम हाइड्रोजन आयोडाइड पाये गये। अभिक्रिया H2 + I2 ⇌ 2 HI के लिए साम्य स्थिरांक की गणना कीजिए। [H = 1,I = 127]
उत्तर


प्रश्न 12.
PCl5 के 2.0 ग्राम-अणु को 3 लीटर के एक पात्र में गर्म किया गया। साम्यावस्था पर 5% PCl5 का वियोजन हो जाता है। इस अभिक्रिया का साम्य स्थिरांक ज्ञात कीजिए।
उत्तर

प्रश्न 13.
1 मोल एथिल ऐल्कोहॉल की 1 मोल ऐसीटिक ऐसिड से अभिक्रिया कराने पर साम्य अवस्था में मोल एथिल ऐसीटेट बनता है। निम्नलिखित अभिक्रिया के लिए साम्यं स्थिरांक की गणना कीजिए
CH3COOH + C2H5OH ⇌ CH3COOC2H55+ H2O
उत्तर

प्रश्न 14.
द्रव्य-अनुपाती क्रिया के नियम का उल्लेख कीजिए। अभिक्रिया के लिए Kc का मान लिखिए।
उत्तर
द्रव्य-अनुपाती क्रिया का नियम–स्थिर ताप पर किसी पदार्थ की क्रिया करने की दर पदार्थ के सक्रिय द्रव्यमान के समानुपाती होती है तथा रासायनिक अभिक्रिया की दर पदार्थ के सक्रिय द्रव्यमानों के गुणनफल के समानुपाती होती है। अभिक्रिया के लिए,

प्रश्न 15.
ला-शातेलिए नियम के आधार पर गैसों की विलेयता पर दाब के प्रभाव को समझाइए।
उत्तर
जब गैसें द्रव में विलेय होती हैं तो आयतन घटता है। आयतन घटने के कारण दाब वृद्धि उनकी विलेयता में सहायक होती है, क्योंकि ला-शातेलिए नियमानुसार दाब वृद्धि से साम्य उस दिशा में परिवर्तित होगा जिसमें आयतन घटता है।
प्रश्न 16.
निम्नलिखित अभिक्रिया की साम्यावस्था पर ताप, दाब तथा सान्द्रता का प्रभाव बताइए
N2(g) + O2(g) ⇌ 2NO(g)- 43,200 कैलोरी
या
उपर्युक्त अभिक्रिया में NO के अधिक उत्पादन की परिस्थितियाँ बताइए।
या
ला-शातेलिए के सिद्धान्त के आधार पर अभिक्रिया N2 + O2 ⇌ 2NO; ∆H – 43.2 किलोकैलोरी की साम्यावस्था पर दाब तथा ताप का क्या प्रभाव पड़ेगा?
उत्तर

यह अभिक्रिया ऊष्मा के अवशोषण द्वारा होती है। अत: ताप बढ़ाने पर साम्य अग्रिम दिशा की ओर अग्रसर होगा, क्योंकि इस दिशा में ऊष्मा का अवशोषण होता है। अत: ताप बढ़ाने पर अधिक नाइट्रिक ऑक्साइड, बनेगी। इस साम्य पर दाब का कोई प्रभाव नहीं होगा, क्योंकि अभिक्रिया होने पर अभिकारक तथा उत्पाद के आयतनों में अन्तर नहीं आता है। N, तथा O, का सान्द्रण बढ़ाने पर भी नाइट्रिक ऑक्साइड अधिक बनेगी।
अतः नाइट्रिक ऑक्साइड के अधिक बनने में अधिक ताप व अभिकारकों के अधिक सान्द्रण सहायक होंगे।
प्रश्न 17.
अभिक्रिया 2SO2(g) + O2(g) ⇌ 2SO3(g) + x कैलोरी की साम्यावस्था पर
(i) ताप परिवर्तन तथा दाब परिवर्तन का क्या प्रभाव पड़ेगा?
या
निम्नलिखित साम्य पर दाब तथा ताप का क्या प्रभाव पड़ेगा?
2SO2(g) + O2(g) ⇌ 2SO3(g) + ऊष्मा
उत्तर

ताप का प्रभाव–यह एक ऊष्माक्षेपी अभिक्रिया है। अतः ताप कम करने पर यह अग्रिम दिशा में होगी
और अधिक SO3 बनेगी।
दाब का प्रभाव–इस अभिक्रिया में दो आयतन SO2 तथा एक आयतन O2 संयोग कर, SO3 के दो। आयतन बनाते हैं, अर्थात् SO3 के बनने में उत्पाद पक्ष में आयतन में कमी होती है। चूंकि दाब बढ़ाने पर अभिक्रिया उस दिशा में होती है, जिस ओर आयतन कम होता है, इसलिए दाब बढ़ाने पर अधिक SO3 बनेगी।
प्रश्न 18.
निम्नलिखित अभिक्रिया में दाब घटाने पर क्या प्रभाव पड़ेगा ?
PCl5 ⇌ PCl2 + Cl2
उत्तर
चूँकि इस अभिक्रिया में उत्पाद पक्ष में आयतन में वृद्धि होती है। ला-शातेलिए के नियमानुसार, दाब घटाने पर अभिक्रिया उस ओर अग्रसर होगी जिस ओर दाब घटने का प्रभाव कम होगा। अतः अभिक्रिया अग्र दिशा में अग्रसर होगी।
प्रश्न 19.
अभिक्रिया PCl5 ⇌ PCl5 + Cl2 में क्लोरीन की उपस्थिति में PCls के वियोजन की मात्रा कम हो जाती है। कारण सहित स्पष्ट कीजिए।
उत्तर
ला-शातेलिए नियम के अनुसार, Cl2 की उपस्थिति में साम्य उस दिशा में विस्थापित होगा जिस ओर Cl2 का प्रभाव कम हो सके, अतः PCl5 के वियोजन की मात्रा कम होगी।
प्रश्न 20.
अभिक्रिया N2 + 3H2 ⇌ 2NH3, ∆H = – 22.6 kcal के लिए उन परिस्थितियों का कारण देते हुए सुझाव दीजिए जिनसे NHS की साम्य सान्द्रता बढ़े।
उत्तर
चूँकि अभिक्रिया में उत्पाद पक्ष में आयतन में कमी होती है। अत: वाष्प दाब में वृद्धि अग्र अभिक्रिया में सहायक होगी। अभिक्रिया में ऊष्मा अवशोषित होती है। अत: ताप-वृद्धि अग्र अभिक्रिया में वृद्धि करेगी अर्थात् NH3 की सान्द्रता बढ़ेगी।
प्रश्न 21.
निम्नलिखित अभिक्रिया में अक्रिय गैस मिलाने पर क्या प्रभाव पड़ेगा ?
PCl5 ⇌ PCl5 + Cl2
उत्तर
स्थिर आयतन पर साम्य निकाय में अक्रिय गैस मिलाने पर साम्यावस्था प्रभावित नहीं होती, क्योंकि अभिकारकों और उत्पादों की सन्द्रिताएँ परिवर्तित नहीं होती हैं। स्थिर दाब पर साम्य निकाय में अक्रिय गैस मिलाने से निकाय का आयतन बढ़ता है, जिसके परिणामस्वरूप साम्य अग्र दिशा में विस्थापित हो जाता है, अर्थात् फॉस्फोरस पेन्टाक्लोराइड अधिक वियोजित होता है।
प्रश्न 22.
विद्युत अपघटनी वियोजन सिद्धान्त के आधार पर उदासीनीकरण अभिक्रिया को समझाइए।
उत्तर
वहे अभिक्रिया जिसमें अम्ल के हाइड्रोजन आयन H+, क्षारक के हाइड्रॉक्साइड आयनों, OH– से संयोग करके जल के अणु, H2O बनाते हैं, उदासीनीकरण कहलाती है।

प्रश्न 23.
निर्जल HCl विद्युत अचालक है, परन्तु जलीय HCl एक अच्छा विद्युत चालक है। समझाइए।
उत्तर
निर्जल HCl में मुक्त आयन नहीं होते, अत: निर्जल HCl विद्युत अचालक होता है, जबकि जलीय HCl में H+ तथा Cl– आयन विलयन में आ जाते हैं, जिस कारण जलीय HCl विद्युत का अच्छा चालक है।
प्रश्न 24.
किसी मोनो बेसिक दुर्बल अम्ल के विलयन का वियोजन स्थिरांक 4×10-10 है। विलयन में H’ की सान्द्रता ज्ञात कीजिए।
उत्तर

प्रश्न 25.
ऐसीटिक अम्ल का वियोजन स्थिरांक 1.6×10-5 है। इस अम्ल के विलयन में H+ आयन की सान्द्रता की गणना कीजिए।
उत्तर

प्रश्न 26.
आयनन (वियोजन) की मात्रा किसे कहते हैं? कारकों का उल्लेख कीजिए, जो आयनन की मात्रा को प्रभावित करते हैं?
उत्तर
पूर्ण अपघट्य का वह भाग जो विलयन में आयनित होता है, आयनन की मात्रा या वियोजन की मात्रा कहलाता है।

आयनन की मात्रा को प्रभावित करने वाले कारक
- ताप-विलयन का ताप बढ़ाने पर यिनन की मात्रा बढ़ जाती है, क्योंकि अधिक ताप अणुओं की गति को बढ़ा देता है तथा अणुओं के बीच आकर्षण बल को कम कर देता है।
- सम-आयन की उपस्थिति-सम-आयन की उपस्थिति में दुर्बल वैद्युत-अपघट्य की आयनन की मात्रा कम हो जाती है; जैसे-NH4OH विलयन में NH4Cl मिलाने पर NH4OH की आयनन की दर घट जाती है।
3. सान्द्रण-वैद्युत-अपघट्यों का आयनन उनके सान्द्रण के व्युत्क्रमानुपाती होता है, अर्थात् सान्द्रता बढ़ने पर आयनन की मात्रा घट जाती है।
प्रश्न 27.
आयनन क्या है? इस पंर ताप तथा सान्द्रता का प्रभाव समझाइए।
उत्तर
जब कोई वैद्युत-अपघट्य जेल या किसी अन्य आयनीकारक विलायक में घोला जाता है, तो उसका अणु दो आवेशित कणों में वियोजित हो जाता है। इन आवेशित कणों को आयन तथा इस क्रिया को आयनन कहते हैं।
ताप का प्रभाव–विलयन का ताप बढ़ाने पर आयनन की मात्रा बढ़ जाती है।
सान्द्रता का प्रभाव-आयनन सान्द्रता के व्युत्क्रमानुपाती होता है; अतः जैसे-जैसे विलयन तनु होता है, आयनन की मात्रा बढ़ती है।
प्रश्न 28.
जल का आयनिक गुणनफल क्या है? इसका 25°C पर मान लिखिए।
उत्तर
स्थिर ताप पर जल में उपस्थित H+ तथा OH– आयनों के सान्द्रण का गुणनफल स्थिर होता है और इसे जल का आयनिक गुणनफल कहते हैं। 25°C पर जल के आयनिक गुणनफल का मान 1×10-14 होता है।
प्रश्न 29.
कारण सहित समझाइए कि सोडियम ऐसीटेट का जलीय विलयन लाल लिटमस को नीला क्यों कर देता है?
या
पोटैशियम ऐसीटेट का pH मान 7 से अधिक क्यों है?
उत्तर
सोडियम या पोटैशियम ऐसीटेट एक प्रबल क्षार तथा दुर्बल अम्ल का लवण है। अतः इसका जलीय विलयन क्षारीय होता है, क्योंकि सोडियम ऐसीटेट को जल में घोलने पर ऐसीटेट आयन जल के अणुओं से अभिक्रिया करके अल्प-आयनित ऐसीटिक अम्ल (CH3COOH) और मुक्त हाइड्रॉक्साइड (OH–) आयन बनाते हैं जिससे विलयन में OH– आयनों की सान्द्रता H+ आयनों की सान्द्रता से अधिक हो जाती है और विलयन क्षारीय हो जाता है तथा यह लाल लिटमस को नीला कर देता है। अतः । इसका pH मान 7 से अधिक होता है।
प्रश्न 30.
रक्त का pH मान कितना होता है?
उत्तर
रक्त का pH मान 7.4 (लगभग) होता है।
प्रश्न 31.
pH मान किसे कहते हैं? इसका हाइड्रोजन सान्द्रण से क्या सम्बन्ध है?
उत्तर
किसी विलयन के एक लीटर में उपस्थित हाइड्रोजन के ग्राम आयनों की मात्रा उस विलयन का – हाइड्रोजन आयन सान्द्रण कहलाती है।
“किसी विलयन का pH मान 10 की ऋणात्मक घात की वह संख्या है जो उस विलयन का H+ आयन सान्द्रण प्रकट करती है।”

इस प्रकार, किसी विलयन के हाइड्रोजन आयन सान्द्रण के व्युत्क्रम के लघुगणक को उस विलयन का pH मान कहते हैं।
शुद्ध जल के लिए pH 7 होती है।
दि pH = 7, तो विलयन उदासीन होगा; pH <7, तो विलयन अम्लीय होगा और pH> 7, तो विलयन क्षारीय होगी।
प्रश्न 32.
एक अम्ल का pH मान 6 है। हाइड्रोजन आयन की सान्द्रता ज्ञात कीजिए।
उत्तर

प्रश्न 33.
यदि एक अम्ल का pH मान 4.5 हो, तो pOH का मान क्या होगा?
उत्तर

प्रश्न 34.
यदि किसी जलीय विलयन का pH = 12 है, तो OH– आयनों की सान्द्रता ज्ञात कीजिए।
उत्तर

प्रश्न 35.
पूर्ण आयनन मानते हुए 10-4 M NaOH के जलीय विलयन के pH मान की गणना कीजिए।
या
NaOH विलयन के pH मान की गणना कीजिए।
हुल


प्रश्न 36.
जल के 100 मिली में 0.4 ग्राम कास्टिक सोडा विलेय है। विलयन के pH की गणना कीजिए।
या
0.4% सोडियम हाइड्रॉक्साइड विलयन के pH मान की गणना कीजिए।
उत्तर

प्रश्न 37.
जल के 100 मिली में HCI के 3.65×10-3 ग्राम घुले हैं। विलयन का pH मान ज्ञात कीजिए तथा विलयन की प्रकृति भी बताइए।
उत्तर

प्रश्न 38.
निम्न क्षारकों को प्रबलता के घटते क्रम में लिखिए
NH4OH, NaOH, H2O, Ba(OH)2
उत्तर

प्रश्न 39.
प्रबल अम्ल तथा दुर्बल क्षार से बने लवण के जल-अपघटन से प्राप्त विलयन की प्रकृति क्या होती है और क्यों?
उत्तर
प्रबल अम्ल तथा दुर्बल क्षार से बने लवण के जल-अपघटन के फलस्वरूप प्रबल अम्ल तथा दुर्बल क्षार बनता है। प्रबल अम्ल बहुत अधिकता में आयनित होकर अधिक H+ आयन देता है तथा दुर्बल क्षार बहुत कम आयनित होने के कारण कम OH– आयन देता है। इसलिए विलयन में H+ आयनों की सान्द्रता OH– आयनों की सान्द्रता से अधिक होती है। फलस्वरूप विलयन अम्लीय गुण प्रदर्शित करता है।
प्रश्न 40.
जल में हाइड्रोजन आयनों की सान्द्रता 10-7 ग्राम-आयन/लीटर है, फिर भी यह उदासीन क्यों होता है ? समझाइए।
उत्तर

प्रश्न 41.
प्रतिरोधक (बफर) विलयन को उदाहरण देकर परिभाषित कीजिए।
उत्तर
प्रतिरोधक विलयन-ऐसा विलयन जिसकी अम्लीयता या क्षारीयता आरक्षित होती है, प्रतिरोधक (बफर) विलयन कहलाता है अर्थात् वह विलयन जिसमें अल्प-मात्रा में अम्ल या क्षार मिलाने पर pH मान अपरिवर्तित रहता है, प्रतिरोधक (बफर) या उभय प्रतिरोधी विलयन कहलाता है। यह विलयन दो प्रकार का होता है-
- अम्लीय प्रतिरोधक—यह दुर्बल अम्ल तथा उसी अम्ल के किसी प्रबल क्षार के साथ बने हुए लवण के विलयनों का मिश्रण होता है; जैसे-CH3COOH तथा CH3COONa का मिश्रण।।
- क्षारकीय प्रतिरोधक—यह दुर्बल क्षार तथा उसी क्षार के किसी प्रबल अम्ल के साथ बने हुए लवण के विलयनों का मिश्रण होता है; जैसे-NH4OH तथा NH4Cl का मिश्रण।
प्रश्न 42.
क्षारीय बफर विलयन की क्रिया-विधि एक उदाहरण देकर समझाइए।
उत्तर
माना कि एक क्षारीय प्रतिरोधक विलयन NH4OH तथा इसके लवण NH4CI के मिश्रण से बनाया जाता है। इस प्रतिरोधक विलयन में NH4OH कम आयनित होने के कारण कम OH– आयन उत्पन्न करता है। इसके अतिरिक्त NH4Cl द्वारा उत्पन्न NH+4, आयनों के कारण NH4OH का आयनन और भी कम हो जाता हैं (सम-आयन प्रभाव)।

अब यदि इस विलयन में N/10 NaOH विलयन मिलाते हैं तो NaOH द्वारा उत्पन्न OH– आयन NH+4 आयन के साथ संयोग करके NH4OH बनाता है जो कि कम आयनित होता है। इस प्रकार, विलयन में OH– आयनों की सान्द्रता नहीं बढ़ती है और विलयन का pH मान स्थिर रहता है।

प्रश्न 43.
फेरिक क्लोराइड का जलीय विलयन अम्लीय क्यों होता है। समझाइए।
या
समझाइए क्यों फेरिक क्लोराइड के जलीय विलयन का pH मान 7 से कम होता है?
उत्तर
FeCl3 एक प्रबल अम्ल तथा दुर्बल क्षार का लवण है। इसके जलीय विलयन में Fe3+ तथा Cl– आयन होते हैं जो क्रमश: जल में उपस्थित OH– तथा H3O– आयनों से संयोग करके दुर्बल क्षार Fe(OH)3 तथा प्रबल अम्ल HCl बनाते हैं।
FeCl3 ⇌ Fe3++ 3Cl–

अम्ल के अधिक आयनित होने के कारण विलयन अम्लीय होता है तथा नीले लिटमस को लाल कर देता है, अर्थात् इसका pH मान 7 से कम होता है।
प्रश्न 44.
KCN का जलीय विलयन क्षारीय होता है। कारण सहित समझाइए।
उत्तर
KCN का जलीय विलयन क्षारीय होता है क्योंकि इसके जल-अपघटन से दुर्बल अम्ल (HCN) व प्रबल क्षार (KOH) बनता है।
प्रश्न 45.
किसी एक अम्लीय बफर विलयन का उदाहरण देते हुए इसकी क्रिया-विधि समझाइए।
उत्तर
CH3COOH तथा CH3COONa का मिश्रण एक अम्लीय प्रतिरोधक विलयन है। इस विलयन का आयनन निम्न प्रकार से होता है
CH3COOH ⇌ CHCOO– + H+
CH3COONa ⇌ CH3COO + Na+
इस विलयन में एक बूंद HCI की मिलाने पर जो H+ आयन उत्पन्न होते हैं, वे ऐसीटेट आयन से संयुक्त होकर कम आयनित CH3COOH बनाते हैं। अत: HCl के समान प्रबल वैद्युत-अपघट्य मिलाने पर भी विलयन के [H+] पर अधिक प्रभाव नहीं पड़ता है।

प्रश्न 46.
NaCI, FeCl3 तथा KNO3 में कौन-सा लवण जल अपघटित होगा? बने हुए विलयन की प्रकृति कैसी होगी? समझाइए।
उत्तर
NaCl, FeCl3 तथा KNO3 में से FeCl3 लवण का जल-अपघटन होगा तथा बना विलयन अम्लीय होगा।
NaCl और KNO3 के जलीय विलयनों में प्रबल अम्ल और प्रबल क्षार बनते हैं जिससे [H3O+] = [OH– ]; अत: इनके विलयन उदासीन होते हैं और इनका जल-अपघटन नहीं होता है।
प्रश्न 47.
सिल्वर आयोडाइड, का विलेयता गुणनफल 10-17 तथा सिल्वर क्लोराइड का विलेयता गुणनफल 10-10 है। यदि AgNO3 को बूंद-बूंद करके पोटैशियम क्लोराइड तथा पोटैशियम आयोडाइड के जलीय विलयन में मिलाया जाता है, तो कौन पहले अवक्षेपित होगा सिल्वर क्लोराइड या सिल्वर आयोडाइड व क्यों ?
उत्तर
सिल्वर आयोडाइड पहले अवक्षेपित होगा क्योकि इसका विलेयता गुणनफल कम है।
प्रश्न 48.
शुद्ध जल में तथा NaCI के जलीय विलयन में AgCI का विलेयता गुणनफल समान रहता है, जबकि AgCI की विलेयता NaCI के विलयन में घटती है। कारण स्पष्ट कीजिए।
उत्तर
सम-आयन प्रभाव के कारण AgCl की विलेयता NaCl विलयन में शुद्ध जल की अपेक्षा बहुत कम होती है। NaCl की उपस्थिति में विलयन में क्लोराइड आयनों (Cl–) की सान्द्रता बढ़ जाने से आयनिक गुणनफल [Ag+]x[Cl–]AgCl के विलेयता गुणनफल (Ksp) से अधिक हो जाता है, जिससे AgCI अवक्षेपित हो जाता है अर्थात् AgCI की विलेयता घट जाती है।
प्रश्न 49.
AgCI का विलेयता गुणनफल 1.56x 10-10 है। AgCI के एक जलीय विलयन में यदि Ag+ की सान्द्रता 1.0×10-5मोल/लीटर है, तो इस विलयन में CL– आयनों की सान्द्रता क्या होगी?
उत्तर

प्रश्न 50.
25°Cपर सिल्वर क्लोराइड (AgCI) का विलेयता गुणनफल 1.5625×10-10 है। इस ताप पर सिल्वर क्लोराइड की विलेयता जल में ग्राम प्रति लीटर में ज्ञात कीजिए।
(Ag = 108, Cl = 35.5)
उत्तर

प्रश्न 51.
बेरियम सल्फेट की ग्राम प्रति लीटर में विलेयता ज्ञात कीजिए, यदि 25°C पर इसका विलेयता गुणनफल ix10-10 तथा अणुभार 233.3 हो।
उत्तर

प्रश्न 52.
यदि PbCl2 की जल में विलेयता 278×10-5 ग्राम प्रति लीटर है, तो PbCl2, का विलेयता गुणनफल ज्ञात कीजिए। (PbCl2 का अणुभार 278 है)
उत्तर

प्रश्न 53.
विलेयता गुणनफल के दो अनुप्रयोग समझाइए।
उत्तर
- साबुन का लवणीकरण–तेल या वसा के साबुनीकरण पर विलयन में वसा अम्लों के सोडियम लवण प्राप्त होते हैं। इसमें NaCl का संतृप्त विलयन मिलाने पर NaCl के Na+ ओयन, साबुन के Na+ आयनों के सान्द्रण को बढ़ा देते हैं, फलस्वरूप [Na+][C17H35COO–] का मान इसके विलेयता गुणनफल से अधिक हो जाता है, जिससे C17H35COONa लवण अवक्षेपित हो जाता है। इस अभिक्रिया को साबुन का लवणीकरण कहते हैं।
- नमक के शोधन में–अशुद्ध नमक के संतृप्त विलयन में HCl गैस प्रवाहित करने पर शुद्ध नमक अवक्षेपित हो जाता है। HCl गैस प्रवाहित करने पर NaCl के Cl– आयनों का सीन्द्रण बढ़ जाता है, जिससे [Na+][Cl–] का मान NaCl के विलेयता गुणनफल से अधिक हो जाता है, अतः NaCl का अवक्षेपण हो जाता है और अशुद्धियाँ विलयन में रह जाती हैं।
लघु उत्तरीय प्रश्न
प्रश्न 1.
456°C पर 8.0 मिली हाइड्रोजन एवं 8.0 मिली आयोडीन की वाष्प की क्रिया होने पर 12 मिली HI बनती है। इस ताप पर अभिक्रिया H2 + I2 ⇌ 2HI के साम्य स्थिरांक की गणना कीजिए। [H = 1,I = 127]
उत्तर
प्रश्नानुसार, H2(g)+ I2(g) ⇌ 2HI(g)
इस अभिक्रिया का साम्य स्थिरांके

आवोगाद्रो नियम के अनुसार, स्थिर ताप और दाब पर
गैस का आयतनं ∝ गैस के अणुओं की संख्या
अतः किसी गैसीय अभिक्रिया में, यदि अणुओं की संख्या परिवर्तित नहीं होती है, तो अभिक्रिया के साम्य स्थिरांक व्यंजक में मोलर सान्द्रताओं के स्थान पर गैसों के आयतन प्रयुक्त किये जा सकते हैं। हाइड्रोजन आयोडाइड के बनने की अभिक्रिया में अणुओं की संख्या परिवर्तित नहीं होती है। अभिक्रिया की समीकरण के अनुसार, एक आयतन H2 और एक आयतन I2 से 2 आयतन HI बनती है। अतः 6 आयतन H2 और 6 आयतन I2 से 12 मिली आयतन HI बनेगा।

प्रश्न 2.
एक निश्चित ताप पर अभिक्रिया N2 + 2O2⇌2NO2 का साम्य स्थिरांक 100 है। पृथक् रूप से निम्न अभिक्रियाओं के साम्य स्थिरांक के मान की गणना कीजिए
(a) 2NO2 ⇌ N2 + 2O2
(b) NO2 ⇌ N2 + O2
उत्तर


प्रश्न 3.
अभिक्रिया N2 + 3H2 ⇌ 2NH3 + Qcal के लिए साम्य स्थिरांक व्यंजक की व्युत्पत्ति कीजिए। इस पर ताप के प्रभाव को समझाइए।
या
किसी उत्क्रमणीय अभिक्रिया का उदाहरण देते हुए साम्य स्थिरांक (Kc) का मान निकालिए।
उत्तर
माना कि निम्न अभिक्रिया V लीटर के बन्द पात्र में N2 के a मोल तथा H2 के 5 मोल लेकर प्रारम्भ की गई जिसमें कुछ समय बाद साम्य स्थापित हो जाता है। माना कि साम्य में NH2 के 2x मोल उत्पन्न होते हैं तो

अतः समीकरण (ii) उपर्युक्त अभिक्रिया के साम्य स्थिरांक़ के व्यंजक को व्यक्त करती है।
उपर्युक्त अभिक्रिया ऊष्माक्षेपी अभिक्रिया है। अतः ला-शातेलिए के नियमानुसार इस अभिक्रिया द्वारा ताप वृद्धि पर अमोनिया के उत्पादन में कमी होगी, अर्थात् ताप वृद्धि अभिक्रिया के विपरीत दिशा में बढ़ने में सहायक होगी।
प्रश्न 4.
एक बंद बर्तन में HI के 1.2 मोलों को द्वियोजित किया जाता है। साम्यावस्था पर HI के वियोजन की मात्रा 44% है। HIके वियोजन की क्रियामाग्यस्थिरांक ज्ञात कीजिए।
उत्तर
HI के मोलों की संख्या 1.2 तथा वियोजन की मात्रा 44% है।

प्रश्न 5.
ला-शातेलिए के सिद्धान्त का उल्लेख कीजिए।
या
ला-शातेलिए नियम की परिभाषा लिखिए। इसका एक अनुप्रयोग दीजिए।
उत्तर
ला-शातेलिए का सिद्धान्त यह एक सार्वभौमिक सिद्धान्त है जो सभी भौतिक तथा रासायनिक तन्त्रों पर लागू होता है। इसके अनुसार,
यदि साम्यावस्था पर ताप, दाब या सान्द्रण का परिवर्तन किया जाए तो साम्यावस्था ऐसी दिशा में परिवर्तित होगी जिससे वह किये गये परिवर्तन (कारक) का प्रभाव दूर करने में सहायक हो।” अतः
- ताप वृद्धि से अभिक्रिया ऐसी दिशा में बढ़ती है जिसमें ऊष्मा का शोषण होता है।
- दाब वृद्धि से अभिक्रिया ऐसी दिशा में बढ़ती है जिसमें आयतन कम होता हो।
- कोई बाह्य पदार्थ मिलाने पर अभिक्रिया ऐसी दिशा में बढ़ती है जिसमें उसे पदार्थ की सान्द्रता कम | होती हो।
अनुप्रयोग-विलेयता पर ताप का प्रभाव–उन सभी पदार्थों की विलेयता ताप बढ़ाने पर बढ़ती है। जिनको घोलने पर ऊष्मा का शोषण होता है; जैसे-
KCI + जल ⇌ जलीय KC1- Q कैलोरी
यदि ताप बढ़ाया जाए तो साम्य ऐसी दिशा को अग्रसर होगा जिसमें ताप का शोषण हो सके, ताकि बढ़े ताप का प्रभाव नष्ट हो सके। अतः ताप बढ़ाने पर KCI की विलेयता बढ़ती है। परन्तु उन पदार्थों की विलेयता ताप बढ़ाने पर घटती है जिनको जल में घोलने पर ऊष्मा निकलती है; जैसे-
Ca(OH)2 + जल → जलीय Ca(OH)2 +O कैलोरी
अत: Ca(OH)2की विलेयता ताप बढ़ाने पर घटती है।
प्रश्न 6.
निम्नलिखित अभिक्रिया की साम्यावस्था पर ताप तथा दाब के प्रभाव की विवेचना ला-शातेलिए के सिद्धान्त के आधार पर कीजिए।
X2(g) + 2Y(g) ⇌ Z(g) +2 कैलोरी
उत्तर
यह अभिक्रिया ऊष्माक्षेपी है तथा इसमें मोलों की संख्या में कमी होती है।
X2(g) + 2Y (g) ⇌ 2(g) +2 कैलोरी
अतः ला-शातेलिए के नियमानुसार,
- ताप का प्रभाव–ताप बढ़ाने पर साम्यावस्था उस ओर विस्थापित होगी जिस ओर ऊष्मा अवशोषित होती है। यह अभिक्रिया ऊष्माक्षेपी है। अतः ताप बढ़ाने पर साम्यावस्था विपरीत अभिक्रिया की दिशा में विस्थापित होती है। अतः उच्च ताप पर Z का निर्माण कम होगा।
- दाब का प्रभाव-दाब बढ़ाने पर साम्यावस्था उस ओर विस्थापित होती है जिस ओर मोलों की संख्या में कमी होती है। अत: दाब वृद्धि पर Z का निर्माण अधिक होगा।
प्रश्न 7.
विद्युत अपघटनी वियोजन सिद्धान्त के आधार पर किसी विद्युत अपघट्य के निम्न गुणों की व्याख्या कीजिए
(i) चालकता तथा
(ii) अपसामान्य अणुसंख्य गुण।
उत्तर
(i) चालकता–विद्युत अपघट्य के जलीय विलयन में विद्युत का प्रवाह ओम के नियम के अनुसार होता है। इससे स्पष्ट है कि विद्युत अपघट्य को वियोजित करने में विद्युत व्यय नहीं होती है। यह तभी सम्भव है जब विलयन में विद्युत प्रवाह करने से पहले ही आयन उपस्थित हों अर्थात् विद्युत अपघट्य जल में घोलने पर आयन देते हैं। आयन उपस्थित होने के कारण विद्युत अपघट्यों के जलीय विलयन विद्युत के चालक होते हैं। HCl गैस का जलीय विलयन विद्युत का चालक है।
HCl + H2O→ H3O++ Cl–
परन्तु HCI गैस विद्युत का अचालक है क्योंकि इसमें आयन नहीं है। यह एक सहसंयोजक यौगिक है।
(ii) अपसामान्य अणुसंख्य गुण-अणुसंख्य गुण विलयन में उपस्थित विलीन पदार्थ के अणुओं व आयनों की संख्या पर निर्भर करते हैं। यदि हम यूरिया और NaCl के समान मोलर सान्द्रता के जलीय विलयन लें तो NaCl के जलीय विलयन का परासरण दाब यूरिया के विलयन से लगभग दो गुना हो जाता है। इसका कारण यह है कि NaCl जल में वियोजित होकर Na+ व Cl– आयन देता है।
NaCl → Na+ + Cl–
परासरण दाब उत्पन्न करने में आयन अणुओं की तरह व्यवहार करते हैं। यूरिया का वियोजन नहीं होता है क्योंकि यह विद्युत अनपघट्य है।
प्रश्न 8.
ओस्टवाल्ड के तनुता नियम का उल्लेख कीजिए एवं उसका सूत्र निकालिए।
या
किसी दुर्बल वैद्युत अपघट्य विलयन की वियोजन मात्रा, विलयन की तनुता बढ़ाने से बढ़ती है। इस कथन से सम्बन्धित नियम की उत्पत्ति कीजिए।
उत्तर
दुर्बल वैद्युत अपघट्यों के लिए द्रव्य-अनुपाती क्रिया का नियम ओस्टवाल्ड का तनुता नियम कहलाता है।
माना एक द्विअंगी (binary) दुर्बल वैद्युत अपघट्य AB का 1 ग्राम-अणु लीटर विलयन में उपस्थित है तथा साम्यावस्था पर वियोजन की मात्रा α है, तो AB के अनआयनित अणुओं एवं इसके आयनों A+ तथा B– में निम्न प्रकारं साम्यावस्था प्रकट की जा सकती है।

किसी दुर्बल अपघट्य के वियोजन की मात्रा-किसी दुर्बल वैद्युत-अपघट्य के विलयन में बहुत कम आयनन होता है। अतः दुर्बल वैद्युत-अपघट्य के विलयन में 0 का मान 1 की अपेक्षा नगण्य मान सकते हैं।

समीकरण (ii) को सरल तनुता सूत्र कहते हैं।
अत: किसी दुर्बल वैद्युत-अपघट्य के वियोजन की मात्रा उसकी तनुता के वर्गमूल के अनुक्रमानुपाती होती है, अर्थात् तनुता बढ़ने से वियोजन की मात्रा बढ़ती है।
प्रश्न 9.
प्रबल क्षारक तथा दुर्बल अम्ल से बने किसी एक लवण को जल में विलेय करने पर प्राप्त विलयन की प्रकृति को समझाइए।
उत्तर
CH3COONa प्रबल क्षारक तथा दुर्बल अम्ल से बना एक प्रमुख लवण है। जल में विलेय करने पर इसमें निम्नलिखित अभिक्रियाएँ होती हैं।

प्रश्न 10.
जल-अपघटने किसे कहते हैं? समझाइए। निम्नलिखित लवणों में किसका जल-अपघटन होगा?
NaCl, CuSO4 तथा KNO3
या
जल-अपघटन को आर्यनन सिद्धान्त के आधार पर परिभाषित कीजिए।
उत्तर
शुद्ध जल उदासीन होता है, क्योंकि यह OH– तथा H3O+ आयनों का सन्तुलित मिश्रण होता है।
H2O+ H2O ⇌ H3O+ +OH–
जब जल में कोई लवण मिला देते हैं तो H3O+ तथा OH– आयनों का सन्तुलन बिगड़ जाता है। फलस्वरूप विलयन अम्लीय या क्षारीय हो जाता है। इस परिघटना को जल-अपघटन कहा जाता है। अतः वह अभिक्रिया जिसमें एक लवण जल से अभिकृत होकर अम्लीय या क्षारीय विलयन उत्पन्न करता है, जल-अपघटन कहलाती है।
NaCl, CuSO4,व KNO3 में CuSO4 का जल-अपघटन होगा, जो निम्न प्रकार होगा-

यहाँ H2SO4 का अधिक आयनन होता है जिसके फलस्वरूप विलयन में H+ आयनों की सान्द्रता अधिक रहती है। अतः CuSO4 का जलीय विलयन अम्लीय होता है।
प्रश्न 11.
विलेयता तथा विलेयता गुणनफल में अन्तर लिखिए। किसी द्विअंगी विद्युत अपघट्य के लिए विलेयता तथा विलेयता गुणनफल में सम्बन्ध स्थापित कीजिए तथा इसका एक उपयोग लिखिए।
था
विलेयता गुणनफल से आप क्या समझते हैं? गुणात्मक विश्लेषण में इसका एक उपयोग लिखिए।
उत्तर
विलेयता तथा विलेयता गुणनफल में अन्तर–निश्चित ताप पर किसी पदार्थ की विलेयता उस पदार्थ की वह मात्रा है जो उस ताप पर 100 ग्राम विलायक को संतृप्त करने के लिए आवश्यक होती है। दूसरी ओर विलेयता गुणनफल स्थिर ताप पर किसी दुर्बल वैद्युत अपघट्य के संतृप्त विलयन में विद्यमान आयनों की सान्द्रताओं का गुणनफल होता है।
विलेयता तथा विलेयता गुणनफल में सम्बन्ध–यह सम्बन्ध केवल अल्प-विलेय वैद्युत-अपघट्यों के लिए ही सम्भव है। माना, किसी विलेय द्विअंगी वैद्युत-अपघट्य AB की विलेयता 5 ग्राम् अणु प्रति लीटर है। अल्प विलेय होने के कारण संतृप्त विलयन में अपघट्य का पूर्ण आयनन सम्भव है। इसीलिए AB पूर्ण आयनन के बाद A+ तथा B का उतना ही सान्द्रण प्रस्तुत करता है जितना कि AB का था। अतः A+ तथा B– आयनों का सान्द्रण पृथक्-पृथक् क्रमश: s ग्राम आयन प्रति लीटर होगा।
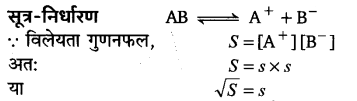
इसीलिए “किसी अल्प विलेय द्विअंगी वैद्युत-अपघट्य की विलेयता उसके विलेयता गुणनफल के वर्गमूल के बराबर होती है।”
विलेयता गुणनफल का उपयोग-विलेयता गुणनफल का प्रमुख उपयोग गुणात्मक विश्लेषण में किया जाता है।
प्रश्न 12.
हेनरी स्थिरांक और विलेयता में सम्बन्ध बताइए। सड़े हुए अण्डों वाली विषैली गैस H,S गुणात्मक विश्लेषण में प्रयुक्त होती है। यदि H,S | गैस की जल में STP पर विलेयता 0.195 हो, तो हेनरी स्थिरांक की गणना कीजिए।
उत्तर
हेनरी स्थिरांक और विलेयता में सम्बन्ध निम्नवत् है-
इस समीकरण से स्पष्ट है कि समान दाब पर विभिन्न गैसों की विलेयता हेनरी स्थिरांक के व्युत्क्रमानुपाती होती है अर्थात् जिन गैसों का हेनरी स्थिरांक उच्च होता है उनकी विलेयता कम होती है। और जिन गैसों का हेनरी स्थिरांक कम होता है, उनकी विलेयता अधिक होती है।
जल में H2S की STP पर विलेयता 0.195 विलयन का अर्थ है कि 1 किग्रा (1000 ग्राम) जल में 0.195 मोल गैस घुली है।।

प्रश्न 13.
विलेयता गुणनफल की परिभाषा दीजिए। द्वितीय समूह तथा चतुर्थ समूह के गुणात्मक विश्लेषण में इसके उपयोग की व्याख्या कीजिए।
उत्तर
[संकेत विलेयता गुणनफल की परिभाषा के लिए अतिलघु उत्तरीय प्रश्न 11 का उत्तर देखें। द्वितीय समूह तथा चतुर्थ समूह के सल्फाइडों का अवक्षेपण-द्वितीय समूह के सल्फाइड HCI की उपस्थिति में तथा चतुर्थ समूह के सल्फाइड NH4OH की उपस्थिति में अवक्षेपित होते हैं। द्वितीय समूह के मूलकों के सल्फाइडों का विलेयता गुणनफल चतुर्थ समूह के मूलकों के सल्फाइडों की अपेक्षा बहुत कम होता है। इसलिए यदि H2S प्रवाहित करने से पहले HCI न मिलाया जाए तो द्वितीय समूह के मूलक तो अवक्षेपित हो ही जाएँगे, इसके साथ-साथ चतुर्थ समूह के मूलकों के सल्फाइड भी आंशिक रूप से अवक्षेपित हो जाते हैं। अत: इनका द्वितीय समूह के सल्फाइड के साथ अवक्षेपण रोकने के लिए HCI मिलाकर ही H2S प्रवाहित की जाती है।
HCI की उपस्थिति में H2S का आयनन सम-आयन प्रभाव के कारण कम हो जाता है।
HCl ⇌H+ + Cl–
H2S ⇌ 2H+ + S2-
इससे विलयन में बहुत कम S2- आयन उत्पन्न होते हैं, परन्तु द्वितीय समूह के मूलकों के सल्फाइडों का विलेयता गुणनफल बहुत कम होता है, अत: S2- आयनों का यह सान्द्रण द्वितीय समूह के मूलकों के सल्फाइडों को अवक्षेपित करने के लिए पर्याप्त होता है, परन्तु चतुर्थ समूह के मूलकों के सल्फाइडों का अवक्षेपण S2- आयनों के कम सान्द्रण होने के कारण नहीं हो पाता। इसलिए वे विलयन में ही रहते हैं। परन्तु NH4OH की उपस्थिति में H2S प्रवाहित करने पर H2S का आयनन बढ़ जाता है, क्योंकि NH4OH से प्राप्त OH– आयन, H2S से प्राप्त H+ आयनों से संयोग करके जल बनाते हैं।
2NH4OH ⇌ 2NH+4 +2OH–
H2S ⇌ S2- +2H+
2H+ + 2OH– ⇌ 2H2O
इससे H+आयन कम हो जाते हैं और H2S का आयनन बढ़ जाता है जिसके फलस्वरूप विलयन में S2-
आयन का सान्द्रण बढ़ता है। इस प्रकार बढ़े S2- आयन का सान्द्रण तथा विलयन में उपस्थित चतुर्थ समूहों के मूलकों के सान्द्रण का गुणनफल चतुर्थ समूह के मूलकों के सल्फाइडों के विलेयता गुणनफल से काफी अधिक हो जाता है। इसके कारण चतुर्थ समूह के मूलकों के सल्फाइड पूर्णतया अवक्षेपित हो जाते हैं।
प्रश्न 14.
“सम-आयन प्रभाव की आर्यनन सिद्धान्त पर व्याख्या कीजिए।
या
सम-आयन प्रभाव क्या है? गुणात्मक विश्लेषण में इसकी कोई एक उपयोगिता लिखिए।
उत्तर
यदि किसी दुर्बल वैद्युत अपघट्य के विलयन में सम-आयन वाला एक दूसरा प्रबल वैद्युत अपघट्य मिलाया जाता है तो दुर्बल वैद्युत अपघट्य के आयनन की मात्रा कम हो जाती है। इस प्रभाव को सम-आयन प्रभाव कहते हैं। निम्नांकित उदाहरण द्वारा इसे स्पष्ट किया जा सकता है। अमोनियम हाइड्रॉक्साइड (NHAOH) एक दुर्बल वैद्युत अपघट्य है जिसका आयनन निम्न प्रकार होता
NH4OH ⇌ NH+4 +OH–
द्रव्य-अनुपाती क्रिया का नियम लगाने पर,
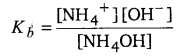
NH4OH के विलयन में NH4CI मिलाने पर NH4OH की आयनन की मात्रा कम हो जाती है, क्योंकि NH4Cl एक प्रबल वैद्युत अपघट्य होने के कारण विलयन में अधिक NH+4 आयन देता है। NH+4 आयनों का सान्द्रण बढ़ने से साम्यावस्था विक्षुब्ध (disturb) हो जाती है। अतः पूर्ण साम्यावस्था स्थापित करने के लिए अथवा समीकरण में Kb का मान स्थिर रखने के लिए OH– आयन का सान्द्रण कम हो जाएगा। यह तभी सम्भव है जब अनआयनित NH4OH का सान्द्रण बढ़े। अत: उत्क्रम दिशा में क्रिया के होने से NH2OH की आयनन की मात्रा कम हो जाती है। इसी प्रकार, CH3COONa की उपस्थिति . में CH3COOH के आयनन की मात्रा घट जाती है।
गुणात्मक विश्लेषण में उपयोग-तृतीय समूह के समूह अभिकर्मक NH4Cl तथा NHAOH हैं। NH4OH एक दुर्बल वैद्युत-अपघट्य है। अत: यह विलयन में कम आयनित होता है।
NH4OH ⇌ NH+4 + OH–
परन्तु कम आयनन के बावजूद भी OH– आयन सान्द्रण इतना होता है कि तृतीय समूह के हाइड्रॉक्साइडों के साथ-साथ चतुर्थ एवं पंचम समूह के मूलक भी हाइड्रॉक्साइडों के रूप में अल्प मात्रा में अवक्षेपित हो जाते हैं। इसीलिए तृतीय समूह में चतुर्थ तथा आगे के समूहों के मूलकों का अवक्षेपण रोकने के लिए NH4OH से पहले NH4CI मिलाया जाता है। NH4CI एक प्रबल वैद्युत-अपघट्य होने के कारण काफी आयनित होता है।
NH4Cl ⇌ NH–4 +Cl– तथा
NH4OH ⇌ NH+4 + OH–
अतः NH+4 आयन सान्द्रण अधिक होने के कारण NH4OH का आयनन सम-आयन प्रभाव के कारण कम हो जाता है जिसके फलस्वरूप OH– आयन का सान्द्रण कम हो जाता है। चूंकि चतुर्थ एवं आगे के समूहों के मूलकों के हाइड्रॉक्साइडों को विलेयता गुणनफल तृतीय समूह के मूलकों के हाइड्रॉक्साइडों से काफी अधिक होता है, इसलिए [OH–][M3+], (M3+ = Fe3+, Al3+,Cr3+) को मान तृतीय समूह के मूलकों के हाइड्रॉक्साइडों के विलेयता गुणनफल से अधिक हो जाता है। अतः तृतीय समूह के मूलक, हाइड्रॉक्साइडों के रूप में पूर्ण अवक्षेपित हो जाते हैं, परन्तु [OH–][M2+], (M2+ = Mn2+, Zn2+, Ni2+,Co2+, Mg2+) का मान चतुर्थ एवं आगे के समूहों के मूलकों के हाइड्रॉक्साइडों के विलेयता गुणनफल से अधिक नहीं होता, इसलिए चतुर्थ एवं आगे के मूलकों का अवक्षेपण नहीं होता है।
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
साम्य स्थिरांक से आप क्या समझते हैं? इसके लिए व्यंजक की व्युत्पत्ति कीजिए।
उत्तर
किसी सामान्य उत्क्रमणीय अभिक्रिया पर विचार करते हैं।
A + B ⇌ C +D

स्थिरांक Kc को साम्य स्थिरांक (equilibrium constant) कहते हैं।
अब, निम्न प्रकार की उत्क्रमणीय अभिक्रिया पर विचार करते हैं।
aA + bB ⇌ cC+ dD
इस प्रकार की अभिक्रिया के लिए द्रव्य-अनुपाती क्रिया के नियमानुसार,

जहाँ, Kc साम्य स्थिरांक है। पादांक c इंगित करता है कि Kc का मान सान्द्रण के मात्रक molL-1 में है। जहाँ यह स्पष्ट होता है कि K का मान सान्द्रता के मात्रक में है वहाँ Kc के स्थान पर सामान्यत: K लिख देते हैं। अत: उपरोक्त व्यंजक को इस प्रकार भी लिख सकते हैं,

K का मान स्थिर ताप पर स्थिर रहता है।
यह व्यंजक साम्य स्थिरांक व्यंजक है। इस व्यंजक को रासायनिक साम्य का नियम (law of chemical equilibrium) भी कहते हैं जिसके अनुसार, “स्थिर ताप पर उत्पादों की मोलर सान्द्रताओं के गुणनफल तथा अभिकारकों की मोलर सान्द्रताओं के गुणनफल का अनुपात, जबकि प्रत्येक सान्द्रता पद को सन्तुलित रासायनिक समीकरण में पदार्थ के स्टॉइकियोमिति गुणांक (stoichiometric coefficient) के बराबर घात दी गयी हो, एक स्थिरांक होता है जिसे साम्य स्थिरांक (equilibrium constant) कहते हैं।”
प्रश्न 2.
सिद्ध कीजिए कि
Kp = Kc[RT]∆n
या
Kp तथा Kc में सम्बन्धं स्थापित कीजिए।
उत्तर


प्रश्न 3.
हेनरी का नियम समझाइए तथा उसके अनुप्रयोग व सीमाएँ भी लिखिए।
उत्तर
सर्वप्रथम विलियम हेनरी (William Henry, 1803) ने विभिन्न गैसों की द्रव में विलेयता पर दाब को मात्रात्मक अध्ययन किया और उस आधार पर एक मात्रात्मक सम्बन्ध प्रस्तुत किया जिसे हेनरी का नियम कहते हैं। इस नियम के अनुसार, “स्थिर ताप पर, किसी विलायक के इकाई आयतन में किसी गैस की घुली हुई मात्रा, उस द्रव की सतह पर साम्यावस्था में उस गैस द्वारा लगाए गए दाब के समानुपाती होती है।”
जब किसी द्रव में कोई गैस घुली हुई हो, तो वह सतह की गैस के साथ निम्नलिखित प्रकार के साम्य में रहती है-

यदि स्थिर ताप पर विलायक के दिए गए आयतन में घुली गैस की मात्रा w हो तथा साम्यावस्था पर गैस का दाब P हो, तो

यहाँ K, एक समानुपाती स्थिरांक है जिसका परिमाण गैस की प्रकृति, विलायक की प्रकृति व ताप पर निर्भर करता है। घुली हुई गैस की मात्रा विलयन में गैस की सान्द्रता के अनुरूप प्रयुक्त की जाती है।
यहाँ K, एक समानुपाती स्थिरांक है जिसका परिमाण गैस की प्रकृति, विलायक की प्रकृति व ताप पर निर्भर करता है। घुली हुई गैस की मात्रा विलयन में गैस की सान्द्रता के अनुरूप प्रयुक्त की जाती है। गैस की विलेयता (सान्द्रता) इसके मोल प्रभाज (X) के रूप में भी प्रयुक्त की जा सकती है। हेनरी नियम के अनुसार स्थिर ताप पर किसी गैस का वाष्प अवस्था में आंशिक दाब (P), उस विलयन में गैस के मोल प्रभाज (X) के समानुपाती होता है। अत: हेनरी के नियम को निम्न प्रकार भी दिया जा सकता है-
P ∝ X
या P = KH.X ……(ii)
जहाँ, KH हेनरी स्थिरांक है, इसका मान गैस की प्रकृति पर निर्भर करता है। यदि गैस के आंशिक दाब (P) तथा मोल प्रभाज (X) के मध्य एक ग्राफ खींचा जाता है तो एक सरल रेखा प्राप्त होती है, जिसका ढाल (slope) KH को व्यक्त करता है, जो दिए गए ग्राफ में दर्शाया गया है। हेनरी के नियम के अनुप्रयोग (Applications of Henry’s law)-इस नियम के प्रमुख अनुप्रयोग निम्न प्रकार हैं-

- शीतल पेयों तथा सोडावाटर की बन्द बोतल में दाब अधिक होने पर CO2 की अधिक मात्रा घुली रहती है, परन्तु जब बोतल खोलते हैं तो दाब कम हो जाता है और ताप में वृद्धि हो जाती है फलस्वरूप CO2 बुदबुदाहट के रूप में बाहर निकलने लगती है की विलेयता दाब बढ़ाने पर बढ़ती है। बन्द बोतल में दाब अधिक होने पर CO2 की अधिक मात्रा घुली रहती है, परन्तु जब बोतल खोलते हैं तो दाब कम हो जाता है और ताप में वृद्धि हो जाती है। फलस्वरूप CO2 बुदबुदाहट के रूप में बाहर निकलने लगती है।
- गोताखोर, गहरे समुद्र में श्वास लेते हुए अधिक दाब महसस करते हैं। अधिक बाह्य दब के कारण वायुमण्डलीय गैसों की रक्त में विलेयता अधिक हो जाती है। जब गोताखोर सतह पर आते हैं तो बाह्य दाब धीरे-धीरे कम होता है इससे रक्त में घुलित गैसें धीरे-धीरे निकलती हैं। जिससे रक्त में नाइट्रोजन के बुलबुले बन जाते हैं जो कोशिकाओं में अवरोध उत्पन्न करते हैं। जिसे बेंड्स (bends) कहते है। इससे शरीर टेढ़ा हो जाता है। इस प्रभाव से बचने के लिए गोताखोर श्वास के लिए उपयोग में आने वाले टैंक में हीलियम मिश्रित वायु (56.2% N2, 32.1% 0, तथा 11.7% He) का प्रयोग करते हैं।
- फेफड़ों से रक्त में O2 व CO2 का आदान-प्रदान हेनरी नियम पर ही आधारित है।
- अधिक ऊँचाई वाले स्थानों पर ऑक्सीजन का आंशिक दाब, मैदानी स्थानों की तुलना में कम होता है। इससे अधिक ऊँचाई वाले स्थानों पर रहने वाले व्यक्तियों के रक्त एवं ऊतकों में ऑक्सीजन की मात्रा कम हो जाती है। ऐसे व्यक्तियों की सोच स्पष्ट नहीं होती है ऐसे लक्षणों को ऐनॉक्सियाँ कहते हैं।
हेनरी के नियम की सीमाएँ—इस नियम की सफलता की कुछ सीमाएँ हैं जो निम्न प्रकार हैं-
- दाब उच्च नहीं होना चाहिए।
- ताप बहुत कम नहीं होना चाहिए।
- गैस की विलायक में विलेयता कम होनी चाहिए।
- गैस की आण्विक अवस्था द्रव व गैसीय दोनों अवस्थाओं में समान होनी चाहिए अर्थात् गैस की आण्विक अवस्था अपरिवर्तित रहनी चाहिए।
- जल में NH3 गैस जल के साथ अभिक्रिया करके NH4OH बना लेती है जो NH+4 व OH– आयन बनाता है और HCl गैस जल में H+ व Cl– में आयनित हो जाती है, अत: जल में NH3 तथा HCl गैसों की विलेयता पर हेनरी को नियम लागू नहीं होता है, जबकि बेन्जीन में NH3 व HCI की विलेयता के लिए हेनरी नियम लागू होता है।
प्रश्न 4.
अम्लीय बफर विलयन के लिए हेन्डरसन समीकरण निष्पादित कीजिए।
उत्तर


We hope the UP Board Solutions for Class 11 Chemistry Chapter 7 Equilibrium (साम्यावस्था) help you.