UP Board Solutions for Class 12 Chemistry Chapter 2 Solutions (विलयन)
UP Board Solutions for Class 12 Chemistry Chapter 2 Solutions (विलयन)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
यदि 22 g बेन्जीन में 122 g कार्बन टेट्राक्लोराइड घुली हो तो बेन्जीन एवं कार्बन टेट्राक्लोराइड के द्रव्यमान प्रतिशत की गणना कीजिए।
हल
विलयन को द्रव्यमान = बेंजीन का द्रव्यमान + कार्बन टेट्राक्लोराइड का द्रव्यमान
= 22 g +122 g = 144 g

प्रश्न 2.
एक विलयन में बेंजीन का 30 द्रव्यमान % कार्बन टेट्राक्लोराइड में घुला हो तो बेन्जीन के मोल अंश की गणना कीजिए।
हल
कार्बन टेट्राक्लोराइड में 30 द्रव्यमान % बेन्जीन का तात्पर्य है,
बेन्जीन का विलयन में द्रव्यमान = 30 g
CCl4 का विलयन में द्रव्यमान = 70 g
बेन्जीन (C6H6) का मोलर द्रव्यमान = 6 x 12 + 6 x 1 = 78 g mol-1
कार्बन टेट्राक्लोराइड (CCl4) का मोलर द्रव्यमान = 12 + 4 x 35.5 = 154 g mol-1
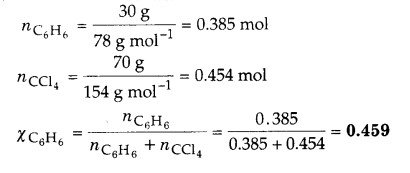
प्रश्न 3.
निम्नलिखित प्रत्येक विलयन की मोलरता की गणना कीजिए –
- 30g, Co(NO3)2 .6H2O 4.3 लीटर विलयन में घुला हुआ हो
- 30 mL 0.5 M-H2SO4 को 500 mL तनु करने पर।
हल
1. Co(NO3)2.6H2O का आण्विक द्रव्यमान
= 58.7 + 2(14 + 48) + 6 x 18 g mol-1 = 310.7 g mol-1
Co(NO3)2.6H2O के मोलों की संख्या = = 0.0966
विलयन का आयतन = 4.3 L

= 0.022 M
2. 1000 mL 0.5M H2SO4 में H2SO4 = 0.5 mol
∴ 30 mL 0.5 M H2SO4 में H2SO4 = x 30 mol = 0.015 mol
विलयन का आयतन = 500 mL = 0.5 L

प्रश्न 4.
यूरिया (NH2CONH2) के 0.25 मोलर, 2.5 kg जलीय विलयन को बनने के लिए आवश्यक यूरिया के द्रव्यमान की गणना कीजिए।
हल
यूरिया के 0.25 मोलर जलीय विलयन से तात्पर्य है –
यूरिया के मोल = 0.25
जल का द्रव्यमान = 1 Kg = 1000 g
यूरिया (NH2CONH2) का मोलर द्रव्यमान
= 14 + 2 + 12 + 16 + 14 + 2 = 60 g mol-1
अतः यूरिया के 0.25 mol = 0.25 mol x 60 g mol-1 = 15 g
विलयन को कुल द्रव्यमान = 1000 + 15 = 1015 g= 1.015 kg
अब, 1.015 kg विलयन में यूरिया = 15 g
अत: 2.5 kg विलयन में आवश्यक यूरिया = x 2.5 kg = 37 g
प्रश्न 5.
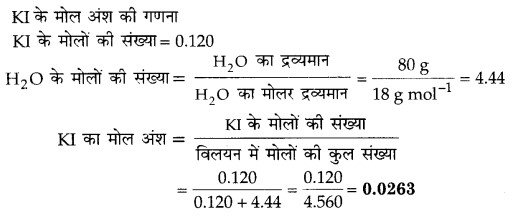
20% (w/w) जलीय KI का घनत्व 1.202 g mL-1 हो तो KI विलयन की
- मोललता
- मोलरता
- मोल-अंश की गणना कीजिए।
हल
20% (द्रव्यमान/द्रव्यमान) जलीय KI विलयन का अभिप्राय है कि KI का द्रव्यमान = 20 g
विलयन में जल को द्रव्यमान = 100 g
जल का द्रव्यमान = 100 – 20 = 80 g= 0.080 kg
1. विलयन की मोललता की गणना
KI का मोलर द्रव्यमान = 39 +127 = 166 g mol-1
KI के मोलों की संख्या = = 0.120

2. विलयन की मोलरता की गणना
विलयन का घनत्व = 1.202 g mL-1
100 g विलयन का आयतन = = 83.2 mL = 0.0832 L

= = 1.44 M
3.
प्रश्न 6.
सड़े हुए अण्डे जैसी गन्ध वाली विषैली गैस H2S गुणात्मक विश्लेषण में उपयोग की जाती है। यदि H2S गैस की जल में STP पर विलेयता 0.195 m हो तो हेनरी स्थिरांक की गणना
कीजिए।
हल

प्रश्न 7.
298 K पर CO2 गैस की जल में विलेयता के लिए हेनरी स्थिरांक का मान 1.67 x 108 Pa है। 500 mL सोडा जल 2.5 atm दाब पर बन्द किया गया। 298 K ताप पर घुली हुई CO2 की मात्रा की गणना कीजिए।
हल

प्रश्न 8.
350 K पर शुद्ध द्रवों A एवं B के वाष्पदाब क्रमशः 450 एवं 750 mm Hg हैं। यदि कुल वाष्प दाब 600 mm Hg हो तो द्रव मिश्रण का संघटन ज्ञात कीजिए। साथ ही वाष्प प्रावस्था का संघटन भी ज्ञात कीजिए।
हल

प्रश्न 9.
298 K पर शुद्ध जल का वाष्प दाब 23.8 mm Hg है। 850 g जल में 50 g यूरिया (NH2CONH2) घोला जाता है। इस विलयन के लिए जल के वाष्प दाब एवं इसके आपेक्षिक अवनमन का परिकलन कीजिए।
हल

प्रश्न 10.
750 mm Hg दाब पर जल का क्वथनांक 99.63°c है। 500 g जल में कितना सुक्रोस मिलाया जाए कि इसका 100°C पर क्वथन हो जाए?
हल

प्रश्न 11.
ऐस्कॉर्बिक अम्ल (विटामिन C, C6H8O6) के उस द्रव्यमान का परिकलन कीजिए जिसे 75 g ऐसीटिक अम्ल में घोलने पर उसके हिमांक में 1.5°C की कमी हो जाए।
Kf = 3.9K kg mol-1
हल
हिमांक में अवनमन (∆Tf) = 1.5°
विलायक (CH3COOH) का द्रव्यमान, w1 = 75 g
विलायक (CH3COOH) का मोलर द्रव्यमान,
M1 = 60 g mol-1
विलेय (C6H8O6) का मोलर द्रव्यमान,
M2 = 176 g mol-1
Kf = 3.9 Kkg mol-1
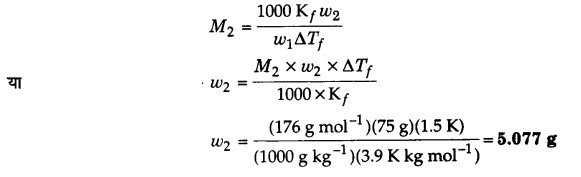
प्रश्न 12.
1,85,000 मोलर द्रव्यमान वाले एक बहुलक के 1.0 g को 37°C पर 450 mL जल में घोलने से उत्पन्न विलयन के परासरण दाब का पास्कल में परिकलन कीजिए।
हल
परासरण दाब π = CRT =
बहुलक को द्रव्यमान w2 = 1.0 g
बहुलक का मोलर द्रव्यमान (M2) = 185000 g mol-1
विलयन का आयतन (V) = 450 mL = 0.45 L
ताप (T)= 37 +273 = 310 K
विलयन स्थिरांक (R) = 8.314 × 103 Pa LK-1 mol-1
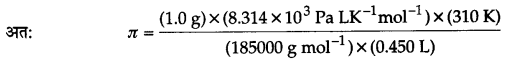
= 30.96 Pa
अतिरिक्त अभ्यास
प्रश्न 1.
विलयन को परिभाषित कीजिए। कितने प्रकार के विभिन्न विलयन सम्भव हैं? प्रत्येक प्रकार के विलयन के सम्बन्ध में एक उदाहरण देकर संक्षेप में लिखिए।
उत्तर
विलयन (Solution) – विलयन दो या दो से अधिक अवयवों का समांगी मिश्रण (homogeneous mixture) होता है जिसका संघटन निश्चित परिसीमाओं के अन्तर्गत ही परिवर्तित हो सकता है।
यहाँ समांगी मिश्रण से तात्पर्य यह है कि मिश्रण में सभी स्थानों पर इसका संघटन व गुण समान होते हैं। विलयन को बनाने वाले पदार्थ विलयन के अवयव कहलाते हैं। किसी विलयन में उपस्थित अवयवों की कुल संख्या के आधार पर इन्हें द्विअंगी विलयन (दो अवयव), त्रिअंगी विलयन (तीन अवयव), चतुरंगी विलयन (चार अवयव) आदि कहा जाता है।
द्विअंगी विलयन के अवयवों को सामान्यत: विलेय तथा विलायक कहा जाता है। सामान्यतः जो अवयव अधिक मात्रा में उपस्थित होता है, वह विलायक कहलाता है, जबकि कम मात्रा में उपस्थित अन्य अवयव विलेय कहलाता है। विलायक विलयन की भौतिक अवस्था निर्धारित करता है जिसमें विलयन विद्यमान होता है। दूसरे शब्दों में विलेय वह पदार्थ है जो घुलता है तथा विलायक वह पदार्थ है जिसमें यह विलेय घुलता है। उदाहरणार्थ– यदि चीनी के कुछ क्रिस्टलों को जल से भरे बीकर में डाला जाता है तो ये जल में घुलकर विलयन बना लेते हैं। इस स्थिति में चीनी विलेय तथा जल विलायक है। विलयन में कणों का आण्विक आकार लगभग 1000 pm होता है तथा इसके विभिन्न अवयवों को किसी भी भौतिक विधि जैसे फिल्टरीकरण, निथारन, अभिकेन्द्रीकरण आदि के द्वारा पृथक्कृत नहीं किया जा सकता है।
विलयन के प्रकार (Types of solution) – विलेय तथा विलायक की भौतिक अवस्था के आधार पर विलयनों को निम्नलिखित प्रकारों में वर्गीकृत किया जा सकता है –
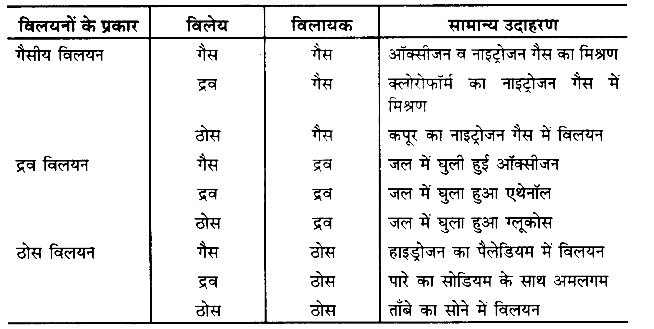
उपर्युक्त नौ प्रकार के विलयनों में से तीन विलयन- द्रव में ठोस, द्रव में गैस तथा द्रव में द्रव अतिसामान्य विलयन हैं। इन तीनों प्रकार के विलयनों में द्रव विलायक के रूप में होता है। वे विलयन जिनमें जल विलायक के रूप में होता है, जलीय विलयन (aqueous solution) कहलाते हैं, जबकि जिन विलयनों में जल विलायक के रूप में नहीं होता अजलीय विलयन (non-aqueous solution) कहलाते हैं। सामान्य अजलीय विलायकों के उदाहरण हैं- ईथर, बेन्जीन, कार्बन टेट्राक्लोराइड आदि।
विलयन के प्रकारों की व्याख्या निम्नलिखित है –
(1) गैसीय विलयन (Gaseous solutions) – सभी गैसें तथा वाष्प समांगी मिश्रण बनाती हैं तथा इसीलिए इन्हें विलयन कहा जाता है। ये विलयन स्वत: तथा तीव्रता से बनते हैं। वायु गैसीय विलयन का एक सामान्य उदाहरण है।
(2) द्रव विलयन (Liquid solutions) – ये विलयन ठोसों अथवा गैसों को द्रवों में मिश्रित करने पर अथवा दो द्रवों को मिश्रित करने पर बनते हैं। कुछ ठोस पदार्थ भी मिश्रित करने पर द्रव विलयन बनाते हैं। उदाहरणार्थ- साधारण ताप पर सोडियम तथा पोटैशियम धातुओं की सममोलर मात्राएँ मिश्रित करने पर द्रव विलयन प्राप्त होता है। जल में पर्याप्त मात्रा में विलेय ऑक्सीजन तालाबों, नदियों तथा समुद्र में जलीय जीवों की प्राण-रक्षा करती है।
इन विलयनों में द्रव में द्रव विलयन अत्यन्त महत्त्वपूर्ण हैं। गैसों के समान द्रव मिश्रित किए जाने पर समांगी मिश्रण नहीं बनाते हैं। इनकी विलेयताओं के आधार पर इन मिश्रणों को तीन प्रकारों में बाँटा जा सकता है –
- जब दोनों अवयव पूर्णतया मिश्रणीय हों (When both components are completely miscible) – इस स्थिति में दोनों द्रव समान प्रवृत्ति के होते हैं अर्थात् या तो ये दोनों ध्रुवी (जैसे-एथिल ऐल्कोहॉल तथा जल) होते हैं या अध्रुवी (जैसे—बेन्जीन तथा हेक्सेन) होते हैं।
- जब दोनों अवयव लगभग मिश्रणीय हों (When both components are almost miscible) – यहाँ एक द्रव ध्रुवी तथा दूसरा अध्रुवी प्रकृति का होता है; जैसे-बेन्जीन तथा जल, तेल तथा जल आदि।
- जब दोनों अवयव आंशिक मिश्रणीय हों (When both components are partially miscible) – यदि द्रव A में अन्तरअणुक आकर्षण A-A, द्रव B में अन्तरअणुक आकर्षण B-B से भिन्न हो, परन्तु A-B आकर्षण माध्यमिक कोटि का हो, तब दोनों द्रव परस्पर सीमित मिश्रणीय होते हैं। उदाहरणार्थ-ईथर तथा जल आंशिक रूप से मिश्रित होते हैं।
(3) ठोस विलयन (Solid solutions) – ठोसों के मिश्रणों की स्थिति में ये विलयन अत्यन्त सामान्य होते हैं। उदाहरणार्थ- गोल्ड तथा कॉपर ठोस विलयन बनाते हैं; क्योंकि गोल्ड परमाणु कॉपर क्रिस्टल में कॉपर परमाणुओं को प्रतिस्थापित कर देते हैं तथा इसी प्रकार कॉपर परमाणु गोल्ड क्रिस्टलों में गोल्ड परमाणुओं को प्रतिस्थापित कर सकते हैं। दो अथवा दो से अधिक धातुओं की मिश्रधातुएँ ठोस विलयन होती हैं।
ठोस विलयनों को दो वर्गों में बाँटा जा सकता है –
- प्रतिस्थापनीय ठोस विलयन (Substitutional solid solutions) – इन विलयनों में एक पदार्थ के परमाणु, अणु अथवा आयन क्रिस्टल जालक में अन्य पदार्थ के कणों का स्थान ले लेते हैं। पीतल, कॉपर तथा जिंक प्रतिस्थापनीय ठोस विलयनों के सामान्य उदाहरण हैं।
- अन्तराकाशी ठोस विलयन (Interstitial solid solutions) – इन विलयनों में एक प्रकार के परमाणु अन्य पदार्थ के परमाणुओं के जालक में विद्यमान रिक्तिकाओं अथवा अन्तराकाशों के स्थान को ग्रहण कर लेते हैं। अन्तराकाशी ठोस विलयन का एक सामान्य उदाहरण टंगस्टन-कार्बाइड (WC) है।
प्रश्न 2.
एक ऐसे ठोस विलयन का उदाहरण दीजिए जिसमें विलेय कोई गैस हो।
उत्तर
चूँकि एक पदार्थ के कण दूसरे पदार्थ के कणों की तुलना में बहुत छोटे हैं, अतः छोटे कण बड़े कणों के अन्तराकाशी स्थलों में व्यवस्थित हो जायेंगे। अतः ठोस विलयन अन्तराकाशी ठोस विलयन (interstitial solid solution) प्रकार का होगा।
प्रश्न 3.
निम्न पदों को परिभाषित कीजिए –
- मोल-अंश (2018)
- मोललता
- मोलरता
- द्रव्यमान प्रतिशत।
या
किसी जलीय विलयन की सान्द्रता व्यक्त करने की किन्हीं चार विधियों का उल्लेख कीजिए। प्रत्येक का एक उदाहरण भी दीजिए। (2018)
उत्तर
1. मोल-अंश (Mole-Fraction) – विलयन में उपस्थित किसी एक घटक या अवयव के मोलों की संख्या तथा विलेय एवं विलायक के कुल मोलों की संख्या के अनुपात को उस अवयव का मोल-अंश कहते हैं। इसे x से व्यक्त करते हैं।
माना एक विलयन में विलेय के nA मोल तथा विलायक के nB मोल उपस्थित हैं, तब

अतः यदि किसी द्विअंगी विलयन के एक अवयव के मोल-अंश ज्ञात हों तो दूसरे अवयव के मोल-अंश ज्ञात किए जा सकते हैं। उदाहरणार्थ-द्विअंगी विलयन के लिए मोल-अंश xA, xB से निम्नलिखित प्रकार सम्बन्धित है –
xA = 1 – xB
या xB = 1 – xA
मोल- अंश विलयन के ताप पर निर्भर नहीं करते हैं।
2. मोललता (Molality) – किसी विलयन के 1 kg विलायक में उपस्थित विलेय के मोलों की संख्या विलयन की मोललता कहलाती है। इसे m से व्यक्त किया जाता है। गणितीय रूप में,
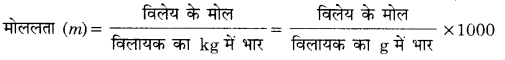
अत: मोललता की इकाई मोल प्रति किग्रा (mol kg-1) होती है।
यदि विलेय के nB मोल विलायक के W ग्राम में घुले हों, तब
मोललता = x 1000
3. मोलरता (Molarity) – एक लीटर (1 क्यूबिक डेसीमीटर) विलयन में घुले हुए विलेय के मोलों की संख्या को उस विलयन की मोलरता (M) कहते हैं।
अत: वह विलयन जिसमें विलेय के एक ग्राम- मोल विलयन के एक लीटर में उपस्थित हों, 1 M विलयन कहलाता है। उदाहरणार्थ– 1M-Na2CO3 (मोलर द्रव्यमान = 106) विलयन के प्रति लीटर में 106 g विलेय उपस्थित होता है।

अतः मोलरता की इकाई मोल प्रति लीटर (mol L-1) या मोल प्रति घन डेसीमीटर (mol dm-3) होती हैं। प्रतीक M को mol L-1 अथवा mol dm-3 के लिए प्रयोग किया जाता है तथा यह मोलरता व्यक्त करता है।
यदि विलेय के nB मोल विलयन के V mL आयतन में उपस्थित हों, तब
मोलरता (M) = x 1000
विलेय के मोल निम्नलिखित प्रकार ज्ञात किए जा सकते हैं –

मोलरता सान्द्रता व्यक्त करने की एक साधारण माप है जिसे प्रयोगशाला में सामान्यतया प्रयोग किया जाता है। यद्यपि इसमें एक कमी है, यह ताप के साथ परिवर्तित हो जाती है क्योंकि ताप के साथ द्रव का प्रसार अथवा संकुचन हो जाता है।
(iv) द्रव्यमान प्रतिशत (Mass Percentage) – किसी विलयन में किसी अवयव का द्रव्यमान प्रतिशत विलयन के प्रति 100 g में उस अवयव का द्रव्यमान होता है। उदाहरणार्थ– यदि विलयन में अवयव A का द्रव्यमान WA तथा अवयव B को द्रव्यमान WB हो तो
A का द्रव्यमान प्रतिशत = × 100
इसे w/w से व्यक्त किया जाता है। उदाहरणार्थ- 10% (w/w) सोडियम क्लोराइड विलयन का अर्थ है। कि 10 g सोडियम क्लोराइड 90 g जल में उपस्थित है तथा विलयन का कुल द्रव्यमान 100 g है अथवा 10 g सोडियम क्लोराइड 100 g विलयन में उपस्थित है।
प्रश्न 4.
प्रयोगशाला कार्य के लिए प्रयोग में लाया जाने वाला सान्द्र नाइट्रिक अम्ल द्रव्यमान की दृष्टि से नाइट्रिक अम्ल का 68% जलीय विलयन है। यदि इस विलयन का घनत्व 1.504 g mL-1 हो तो अम्ल के इस नमूने की मोलरता क्या होगी?
हल
द्रव्यमानानुसार 68% HNO3 का तात्पर्य है कि 100 g विलयन में 68 g HNO3 उपस्थित होगा।

प्रश्न 5.
ग्लूकोस का एक जलीय विलयन 10% (w/w) है। विलयन की मोललता तथा विलयन में प्रत्येक घटक का मोल-अंश क्या है? यदि विलयन का घनत्व 1.2 g mL-1 हो तो विलयन की मोलरता क्या होगी?
हल
10%(w/w) ग्लूकोस विलयन का तात्पर्य है कि 100 g ग्लूकोस विलयन में 10 g ग्लूकोस उपस्थित होगा।
जल का द्रव्यमान = 100 – 10 = 90 g= 0.090 kg
10 g ग्लूकोस = mol = 0.0555 mol,
90 g H2O = = 5 mol
मोललता (m)= = 0.617 m

प्रश्न 6.
यदि 1 g मिश्रण में Na2CO3 एवं NaHCO3 के मोलों की संख्या समान हो तो इस मिश्रण से पूर्णतः क्रिया करने के लिए 0.1 M HCl के कितने mL की आवश्यकता होगी?
हल


प्रश्न 7.
द्रव्यमान की दृष्टि से 25% विलयन के 300 g एवं 40% के 400 g को आपस में मिलाने पर प्राप्त मिश्रण का द्रव्यमान प्रतिशत सान्द्रण निकालिए।
हल
25% विलयन का तात्पर्य है कि 25 g विलेय 100 g विलयन में उपस्थित है तथा 40% विलयन का तात्पर्य है कि 40 g विलेय 100 g विलयन में उपस्थित है।
300 g विलयन में विलेय = = 75 g
400 g विलयन में विलेय = = 160 g
∴ विलेय का कुल द्रव्यमान = 75 + 160 = 235 g
∴ मिश्रण में विलेय का द्रव्यमान प्रतिशत = = 33.57 %
प्रश्न 8.
222.6 g, एथिलीन ग्लाइकॉल, C2H4(OH)2 तथा 200 g जल को मिलाकर प्रतिहिम मिश्रण बनाया गया। विलयन की मोललता की गणना कीजिए। यदि विलयन का घनत्व 1.072 g mL-1 हो तो विलयन की मोलरता निकालिए।
हल

प्रश्न 9.
एक पेय जल का नमूना क्लोरोफॉर्म (CHCl3) से कैंसरजन्य समझे जाने की सीमा तक बहुत अधिक संदूषित है। इसमें संदूषण की सीमा 15 ppm (द्रव्यमान में) है –
(i) इसे द्रव्यमान प्रतिशत में व्यक्त कीजिए।
(ii) जल के नमूने में क्लोरोफॉर्म की मोललता ज्ञात कीजिए।
हल
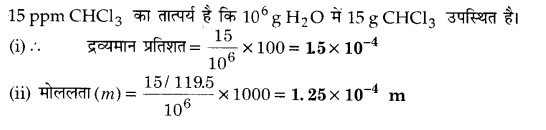
प्रश्न 10.
ऐल्कोहॉल एवं जल के एक विलयन में आण्विक अन्योन्यक्रिया की क्या भूमिका है?
उत्तर
ऐल्कोहॉल एवं जल के विलयन में ऐल्कोहॉल तथा जल के अणु अन्तराआण्विक H- बन्ध बनाते हैं। लेकिन यह H2O-H2O तथा ऐल्कोहॉल-ऐल्कोहॉल H-बन्ध से दुर्बल होते हैं। इससे अणुओं की वाष्प अवस्था में जाने की प्रवृत्ति बढ़ जाती है। अत: यह विलयन राउल्ट के नियम से धनात्मक विचलन प्रदर्शित करता है।
प्रश्न 11.
ताप बढ़ाने पर गैसों की द्रवों में विलेयता में हमेशा कमी आने की प्रवृत्ति क्यों होती है?
उत्तर
गैस + विलायक विलयन + ऊष्मा
गैस का द्रव में घुलना एक ऊष्माक्षेपी प्रक्रम है। ताप बढ़ाने पर साम्य बायीं ओर विस्थापित होता है और विलयन से गैस मुक्त होती है।
प्रश्न 12.
हेनरी का नियम तथा इसके कुछ महत्त्वपूर्ण अनुप्रयोग लिखिए।
उत्तर
हेनरी का नियम (Henry’s Law) – सर्वप्रथम गैस की विलायक में विलेयता तथा दाब के मध्य मात्रात्मक सम्बन्ध हेनरी ने दिया। इसे हेनरी का नियम कहते हैं। इसके अनुसार, ‘‘स्थिर ताप पर विलायक के प्रति एकांक आयतन में घुला गैस का द्रव्यमान विलयन के साथ साम्यावस्था में गैस के दाब के समानुपाती होता है।’
डाल्टन, जो हेनरी के समकालीन थे, ने भी स्वतन्त्र रूप से निष्कर्ष निकाला कि किसी द्रवीय विलयन में गैस की विलेयता गैस के आंशिक दाब पर निर्भर करती है। यदि हम विलयन में गैस के मोल-अंश को उसकी विलेयता का माप मानें तो यह कहा जा सकता है कि किसी विलयन में गैस का मोल-अंश उस विलयन के ऊपर उपस्थित गैस के आंशिक दाब के समानुपाती होता है।
अत: विकल्पतः हेनरी नियम को इस प्रकार व्यक्त किया जा सकता है –
“किसी गैस का वाष्प-अवस्था में आंशिक दाब (p), उस विलयन में गैस के मोल-अंश (x) के समानुपाती होता है।”
p α x
p= KH . x
यहाँ KH हेनरी स्थिरांक है। जब एक से अधिक गैसों के मिश्रण को विलायक के सम्पर्क में लाया जाता है, तब प्रत्येक गैसीय अवयव अपने आंशिक दाब के समानुपात में घुलता है। इसीलिए हेनरी नियम अन्य गैसों की उपस्थिति से स्वतन्त्र होकर प्रत्येक गैस पर लागू किया जाता है।
हेनरी नियम के अनुप्रयोग (Applications of Henry’s Law) – हेनरी नियम के उद्योगों में अनेक अनुप्रयोग हैं एवं यह कुछ जैविक घटनाओं को समझने में सहायक होता है। इसके कुछ महत्त्वपूर्ण अनुप्रयोग निम्नलिखित हैं –
(1) सोडा-जल एवं शीतल पेयों में CO2 की विलेयता बढ़ाने के लिए बोतल को अधिक दाब पर बन्द किया जाता है।
(2) गहरे समुद्र में श्वास लेते हुए गोताखोरों को अधिक दाब पर गैसों को अधिक घुलनशीलता का सामना करना पड़ सकता है। अधिक बाहरी दाब के कारण श्वास के साथ ली गई वायुमण्डलीय गैसों की विलेयता रुधिर में अधिक हो जाती है। जब गोताखोर सतह की ओर आते हैं, बाहरी दाब धीरे-धीरे कम होने लगता है। इसके कारण घुली हुई गैसें बाहर निकलती हैं, इससे रुधिर में नाइट्रोजन के बुलबुले बन जाते हैं। यह केशिकाओं में अवरोध उत्पन्न कर देता है और एक चिकित्सीय अवस्था उत्पन्न कर देता है। जिसे बेंड्स (Bends) कहते हैं, यह अत्यधिक पीड़ादायक एवं जानलेवा होता है। बेंड्स से तथा नाइट्रोजन की रुधिर में अधिक मात्रा के जहरीले प्रभाव से बचने के लिए, गोताखोरों द्वारा श्वास लेने के लिए उपयोग किए जाने वाले टैंकों में हीलियम मिलाकर तनु की गई वायु को भरा जाता है (इस वायु को संघटन इस प्रकार होता है-11.7% हीलियम, 56.2% नाइट्रोजन तथा 32.1% ऑक्सीजन)।
(3) अधिक ऊँचाई वाली जगहों पर ऑक्सीजन का आंशिक दाब सतही स्थानों से कम होता है, अत: इन जगहों पर रहने वाले लोगों एवं आरोहकों के रुधिर और ऊतकों में ऑक्सीजन की सान्द्रता निम्न हो जाती है। इसके कारण आरोहक कमजोर हो जाते हैं और स्पष्टतया सोच नहीं पाते। इन लक्षणों को एनॉक्सिया कहते हैं।
प्रश्न 13.
6.56 x 10-3 g एथेन युक्त एक संतृप्त विलयन में एथेन का आंशिक दाब 1 bar है। यदि विलयन में 5.00 x 10-2 g एथेन हो तो गैस का आंशिक दाब क्या होगा?
हल
m = KH x p
प्रथम मामले में, 6.56 x 10-2 g = KH x 1 bar
KH = 6.56 x 10-2 g bar-1
द्वितीय मामले में, 5.00 x 10-2 g = (6.56 x 10-2 g bar-1) x p
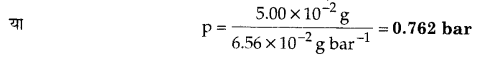
प्रश्न 14.
राउल्ट के नियम से धनात्मक एवं ऋणात्मक विचलन का क्या अर्थ है तथा Δमिश्रण H का चिह्न इन विचलनों से कैसे सम्बन्धित है?
उत्तर
जब कोई विलयन सभी सान्द्रताओं पर राउल्ट के नियम का पालन नहीं करता तो वह अनादर्श विलयन (non-ideal solution) कहलाता है। इस प्रकार के विलयनों का वाष्प दाब राउल्ट के नियम द्वारा निर्धारित किए गए वाष्प दाब से या तो अधिक होता है या कम। यदि यह अधिक होता है तो यह विलयन राउल्ट के नियम से धनात्मक विचलन (positive deviation) प्रदर्शित करता है और यदि यह कम होता है तो यह ऋणात्मक विचलन (negative deviation) प्रदर्शित करता है।
(i) राउल्ट नियम से धनात्मक विचलन प्रदर्शित करने वाले अनादर्श विलयन (Non-ideal solutions showing positive deviation from Raoult’s law) – दो अवयवों A तथा B वाले एक द्विअंगी विलयन पर विचार करते हैं। यदि विलयन में A-B अन्योन्यक्रियाएँ A-A तथा B-B अन्योन्यक्रियाओं की तुलना में दुर्बल होती हैं अर्थात् विलेय-विलायक अणुओं के मध्य अन्तराआण्विक आकर्षण बल विलेय-विलेय और विलायक-विलायक अणुओं की तुलना में दुर्बल होते हैं, तब इस प्रकार के विलयनों में से A अथवा B के अणु शुद्ध अवयव की तुलना में सरलता से पलायन कर सकते हैं। इसके परिणामस्वरूप विलयन के प्रत्येक अवयव का वाष्प दाब राउल्ट नियम के आधार पर अपेक्षित वाष्प दाब से अधिक होता है। इस प्रकार कुल वाष्प दाब भी अधिक होता है। विलयन का यह व्यवहार राउल्ट नियम से धनात्मक विचलन के रूप में जाना जाता है।
गणितीय रूप से इसे इस प्रकार व्यक्त कर सकते हैं –
PA > PºA xA तथा PB > PºBxB
इसी प्रकार कुल वाष्प दाब, p = pA + pB सदैव (pºAxA + pºBxB) से अधिक होता है।
इस प्रकार के विलयनों में, Δमिश्रण H शून्य नहीं होता, अपितु धनात्मक होता है क्योकि A-A अथवा B-B आकर्षण बलों के विरुद्ध ऊष्मा की आवश्यकता होती है। अत: घुलनशीलता ऊष्माशोषी प्रक्रिया होती है।
(ii) राउल्ट नियम से ऋणात्मक विचलन प्रदर्शित करने वाले अनादर्श विलयन (Non-ideal solutions showing negative deviation from Raoult’s law) – इस प्रकार के विलयनों में A-A व B-B के बीच अन्तराआण्विक आकर्षण बल A-B की तुलना में दुर्बल होता है, अत: इस प्रकार के विलयनों में A तथा B अणुओं की पलायन प्रवृत्ति शुद्ध अवयव की तुलना में कम होती है, परिणामस्वरूप विलयन के प्रत्येक अवयव का वाष्प दाब राउल्ट नियम के आधार पर अपेक्षित वाष्प दाब से कम होता है। इसी प्रकार कुल वाष्प दाब भी कम होता है। गणितीय रूप में,

इस प्रकार के विलयनों में Δमिश्रण H शून्य नहीं होता, अपितु ऋणात्मक होता है क्योंकि आकर्षण बलों में वृद्धि से ऊर्जा उत्सर्जित होती है। अत: घुलनशीलता ऊष्माक्षेपी प्रक्रिया होती है।
प्रश्न 15.
विलायक के सामान्य क्वथनांक पर एक अवाष्पशील विलेय के 2% जलीय विलयन का 1.004 bar वाष्प दाब है। विलेय का मोलर द्रव्यमान क्या है?
हल
क्वथनांक पर शुद्ध जल का वाष्प दाब (p°) = 1 atm = 1.013 bar
विलयन का वाष्प दाब (ps) = 1.004 bar
विलेय का द्रव्यमान (w2) = 2 g
विलयन का द्रव्यमान = 100 g
विलयन का द्रव्यमान = 98 g
तनु विलयनों के लिए राउल्ट के नियमानुसार,
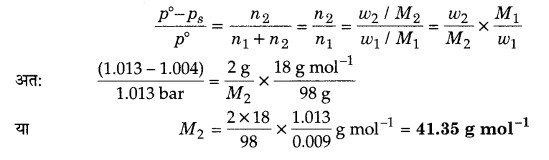
प्रश्न 16.
हेप्टेन एवं ऑक्टेन एक आदर्श विलयन बनाते हैं। 373 K पर दोनों द्रव घटकों के वाष्प दाब क्रमशः 105.2 k Pa तथा 46.8 k Pa हैं। 26.0 g हेप्टेन एवं 35.0 g ऑक्टेन के मिश्रण का वाष्प दाब क्या होगा?
हल

प्रश्न 17.
300 K पर जल का वाष्प दाब 12.3 k Pa है। इसमें बने अवाष्पशील विलेय के एक मोलल विलयन का वाष्प दाब ज्ञात कीजिए।
हल
एक मोलल विलयन का तात्पर्य है कि 1 kg विलायक (जल) में विलेय का 1 mol उपस्थित है।
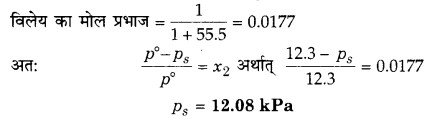
प्रश्न 18.
114 g ऑक्टेन में किसी अवाष्पशील विलेय (मोलर द्रव्यमान 40 gmol-1) की कितनी मात्रा घोली जाए कि ऑक्टेन का वाष्प दाब घट कर मूल वाष्प दाब का 80% रह जाए?
हल
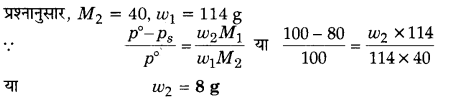
प्रश्न 19.
एक विलयन जिसे एक अवाष्पशील ठोस के 30 g को 90 g जल में विलीन करके बनाया गया है। उसका 298 K पर वाष्प दाब 2.8 k Pa है। विलयन में 18 g जल और मिलाया जाता है जिससे नया वाष्प दाब 298 K पर 2.9 k Pa हो जाता है। निम्नलिखित की गणना कीजिए-
(i) विलेय का मोलर द्रव्यमान
(ii) 298 K पर जल का वाष्प दाब।
हल
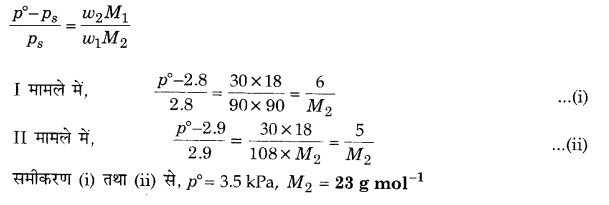
प्रश्न 20.
शक्कर के 5% (द्रव्यमान) जलीय विलयन का हिमांक 271 K है। यदि शुद्ध जल को हिमांक 273.15 K है तो ग्लूकोस के 5% जलीय विलयन के हिमांक की गणना कीजिए।
हल

प्रश्न 21.
दो तत्व A एवं B मिलकर AB2 एवं AB4 सूत्र वाले दो यौगिक बनाते हैं। 20 g बेन्जीन में घोलने पर 1g AB2 हिमांक को 2.3 K अवनमित करता है, जबकि 1.0 g AB4 से 1.3 K का अवनमन होता है। बेन्जीन के लिए मोलर अवनमन स्थिरांक 5.1 K kg mol-1 है। A एवं B के परमाण्वीय द्रव्यमान की गणना कीजिए।
हल

प्रश्न 22.
300 K पर 36 g प्रति लीटर सान्द्रता वाले ग्लूकोस के विलयन का परासरण दाब 4.98 bar है। यदि इसी ताप पर विलयन का परासरण दाब 1.52 bar हो तो उसकी सान्द्रता क्या होगी?
हल
प्रश्नानुसार, परासरण दाब = 4.98 bar, w = 36 g, V = 1 L (I मामले में)
परासरण दाब = 1.52 bar (II मामले में)
I के लिए, πV = RT
4.98 × 1 = × R × T
II के लिए, 1.52 = c x R x T(c = )
समीकरण (i) तथा (ii) को हल करने पर, c= 0.061 mol L-1
प्रश्न 23.
निम्नलिखित युग्मों में उपस्थित सबसे महत्त्वपूर्ण अन्तरआण्विक आकर्षण बलों का सुझाव दीजिए –
- n-हेक्सेन व n-ऑक्टेन
- I2 तथा CCl4
- NaClO4 तथा H2O
- मेथेनॉल तथा ऐसीटोन
- ऐसीटोनाइट्राइल (CH3CN) तथा ऐसीटोन (C3H6O)।
उत्तर
- लण्डन परिक्षेपण बल,
- लण्डन परिक्षेपण बल,
- आयन-द्विध्रुव अन्योन्यक्रियाएँ,
- द्विध्रुव-द्विध्रुव अन्योन्य क्रियाएँ
- द्विध्रुव–द्विध्रुव अन्योन्यक्रियाएँ।
प्रश्न 24.
विलेय-विलायक आकर्षण के आधार पर निम्नलिखित को n-ऑक्टेन में विलेयता के बढ़ते क्रम में व्यवस्थित कीजिए –
KCl, CH3OH, CH3CN, साइक्लोहेक्सेन।
उत्तर
KCl < CH3OH < CH3CN < साइक्लोहेक्सेन
KCl आयनिक यौगिक,है। अत: यह अध्रुवीय विलायक में नहीं घुलता, अत: यह 2-ऑक्टेन में सबसे कम विलेय है। साइक्लोहेक्सेन अध्रुवीय होने के कारण n-ऑक्टेन में आसानी से विलेय होती है। CH3CN, CH3OH की तुलना में कम ध्रुवीय है, अत: इसकी विलेयता CH3OH से अधिक होती है।
प्रश्न 25.
पहचानिए कि निम्नलिखित यौगिकों में से कौन-से जल में अत्यधिक विलेय, आंशिक रूप से विलेय तथा अविलेय हैं –
- फीनॉल
- टॉलूईन
- फॉर्मिक अम्ल
- एथिलीन ग्लाइकॉल
- क्लोरोफॉर्म
- पेन्टेनॉल।
उत्तर
- आंशिक विलेय,
- अविलेय,
- अत्यधिक विलेय,
- अत्यधिक विलेय,
- अविलेय,
- आंशिक विलेय।
प्रश्न 26.
यदि किसी झील के जल का घनत्व 1.25 g mL-1 है तथा उसमें 92 g Na+ आयन प्रति किलो जल में उपस्थित हैं तो झील में Na+ आयन की मोललता ज्ञात कीजिए।
हल
विलेय का भार = 92 g, विलायक का भार = 1000 g

प्रश्न 27.
अगर CuS का विलेयता गुणनफल 6 x 10-16 है तो जलीय विलयन में उसकी अधिकतम मोलरता ज्ञात कीजिए।
हल
जलीय विलयन में CuS की अधिकतम मोलरता = mol L-1 में CuS की विलेयता यदि mol L-1 में Cus की विलेयता s है तो
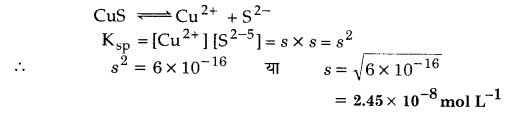
प्रश्न 28.
जब 6.5 g ऐस्पिरीन (C9H8O4) को 450 g ऐसीटोनाइट्राइल (CH3CN) में घोला जाए तो ऐस्पिरीन का ऐसीटोनाइट्राइल में भार प्रतिशत ज्ञात कीजिए।
उत्तर

प्रश्न 29.
नैलॉन (C19H21NO3) जो कि मॉर्फीन जैसी होती है, का उपयोग स्वापक उपभोक्ताओं द्वारा स्वापक छोड़ने से उत्पन्न लक्षणों को दूर करने में किया जाता है। सामान्यतया नैलॉन की 1.5 mg खुराक दी जाती है। उपर्युक्त खुराक के लिए 1.5 x 10-3 m जलीय विलयन का कितना द्रव्यमान आवश्यक होगा?
हल
विलेय का भार = 1.5 mg= 0.0015 g,
विलेय का अणुभार = 311,
विलायक को भार = w

विलायक का भार = 3.2154 g,
विलयन का भार = 3.2154 + 0.0015 = 3.2159 g
प्रश्न 30.
बेन्जोइक अम्ल का मेथेनॉल में 0.15 m विलयन बनाने के लिए आवश्यक मात्रा की गणना कीजिए।
हल
V = 250 ml, m = 0.15 m, विलेय का अणुभार = 122, विलेय की मात्रा = ?

प्रश्न 31.
ऐसीटिक अम्ल, ट्राइक्लोरोऐसीटिक अम्ल एवं ट्राइफ्लुओरो ऐसीटिक अम्ल की समान मात्रा से जल के हिमांक में अवनमन इनके उपर्युक्त दिए गए क्रम में बढ़ता है। संक्षेप में समझाइए।
उत्तर
हिमांक में अवनमन निम्न क्रम में होता है –
ऐसीटिक अम्ल < ट्राइक्लोरोऐसीटिक अम्ल < ट्राइफ्लुओरोऐसीटिक अम्ल
फ्लोरीन अधिक ऋणविद्युती होने के कारण उच्चतम इलेक्ट्रॉन निष्कासन प्रेरणिक प्रभाव रखती है। अतः ट्राइफ्लुओरोऐसीटिक अम्ल प्रबल अम्ल है जबकि ऐसीटिक अम्ल दुर्बलतम अम्ल है।। अतः ट्राइफ्लुओरोऐसीटिक अम्ल अत्यधिक आयनित होकर अधिक आयन उत्पन्न करता है जबकि ऐसीटिक अम्ल सबसे कम आयन उत्पन्न करता है। अधिक आर्यन उत्पन्न करने के कारण ट्राइफ्लुओरोऐसीटिक अम्ल हिमांक में अधिक अवनमन करता है एवं ऐसीटिक अम्ल सबसे कम।
प्रश्न 32.
CH3 – CH2 – CHCl – COOH के 10 g को 250 g जल में मिलाने से होने वाले हिमांक का अवनमन परिकलित कीजिए। (Ka = 1.4 × 10-3, Kf = 186 K kg mol-1)
हल

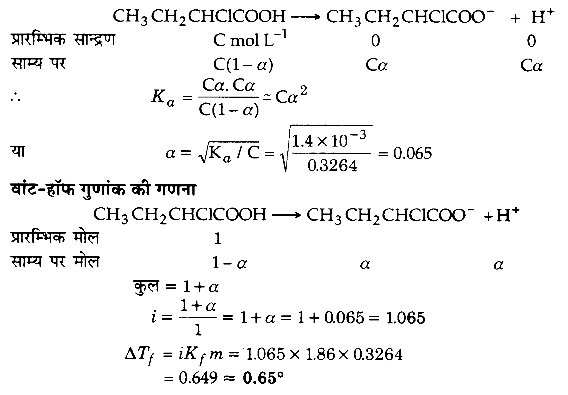
प्रश्न 33.
CH2FCOOH के 19.5 g को 500 g H2O में घोलने पर जल के हिमांक में 10°C का अवनमन देखा गया। फ्लुओरोऐसीटिक अम्ल का वान्ट हॉफ गुणक तथा वियोजन स्थिरांक परिकलित कीजिए।
हल


प्रश्न 34.
293 K पर जल का वाष्प दाब 17.535 mm Hg है। यदि 25 g ग्लूकोस को 450 g जल में घोलें तो 293 K पर जल का वाष्प दाब परिकलित कीजिए।
हल

प्रश्न 35.
298 K पर मेथेन की बेन्जीन में मोललता का हेनरी स्थिरांक 4.27 x 105 mm Hg है। 298 K तथा 760 mm Hg दाब पर मेथेन की बेन्जीन में विलेयता परिकलित कीजिए।
हल
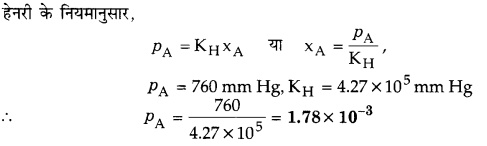
प्रश्न 36.
100 g द्रव A (मोलर द्रव्यमान 140 g mol-1) को 1000 g द्रव B (मोलर द्रव्यमान 180 g mol-1) में घोला गया। शुद्ध द्रव B का वाष्प दाब 500 Torr पाया गया। शुद्ध द्रव A का वाष्प दाब तथा विलयन में उसका वाष्प दाब परिकलित कीजिए यदि विलयन का कुल वाष्प दाब 475 Torr हो।
हल

प्रश्न 37.
328 K पर शुद्ध ऐसीटोन एवं क्लोरोफॉर्म के वाष्प दाब क्रमशः 741.8 mm Hg तथा 632.8 mm Hg हैं। यह मानते हुए कि संघटन के सम्पूर्ण परास में ये आदर्श विलयन बनाते हैं, Pकल , Pक्लोरोफॉर्म तथा Pएसीटोन को xएसीटोन के फलन के रूप में आलेखित कीजिए। मिश्रण के विभिन्न संघटनों के प्रेक्षित प्रायोगिक आँकड़े अग्रलिखित हैं –
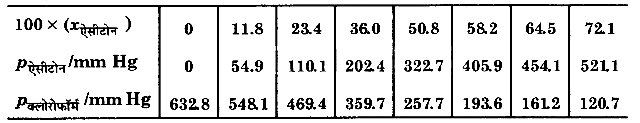
उपर्युक्त आँकड़ों को भी उसी ग्राफ में आलेखित कीजिए और इंगित कीजिए कि क्या इसमें आदर्श विलयन से धनात्मक अथवा ऋणात्मक विचलन है?
हल

उपर्युक्त आँकड़ों के आधार पर ग्राफ की प्रकृति निम्नलिखित है –
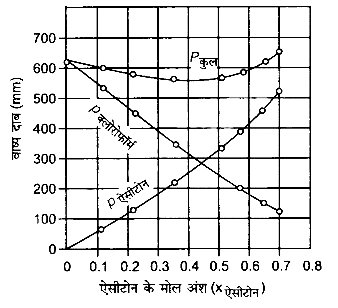
चूंकि Pकल का ग्राफ नीचे की ओर झुका है, अत: विलयन राउल्ट के नियम से ऋणात्मक विचलन प्रदर्शित कर रहा है।
प्रश्न 38.
संघटनों के सम्पूर्ण परास में बेन्जीन तथा टॉलूईन आदर्श विलयन बनाते हैं। 300 K पर शुद्ध बेन्जीन तथा टॉलूईन का वाष्प दाब क्रमशः 50.71 mm Hg तथा 32.06 mm Hg है। यदि 80 g बेन्जीन को 100 g टॉलूईन में मिलाया जाए तो वाष्प अवस्था में उपस्थित बेन्जीन के मोल-अंश परिकलित कीजिए।
हल
द्रव अवस्था में nB = = 1.026, nT =
= 1.087
XB = 0.486, XT = 0.514
PB = 50.71 x 0.486 = 24.65
pT = 32.06 x 0.514 = 16.48
बेंजीन का वाष्प अवस्था में मोल प्रभाज = = 0.60
प्रश्न 39.
वायु अनेक गैसों का मिश्रण है। 298 K पर आयतन में मुख्य घटक ऑक्सीजन और नाइट्रोजन लगभग 20% एवं 79% के अनुपात में हैं। 10 वायुमण्डल दाब पर जल वायु के साथ साम्य में है। 298 K पर यदि ऑक्सीजन तथा नाइट्रोजन के हेनरी स्थिरांक क्रमशः 3.30 x 107 mm तथा 6.51 x 107 mm हैं तो जल में इन गैसों का संघटन ज्ञात कीजिए।
हल

प्रश्न 40.
यदि जल का परासरण दाब 27°C पर 0.75 वायुमण्डल हो तो 2.5 लीटर जल में घुले CaCl2 (i = 2.47) की मात्रा परिकलित कीजिए।
हल

प्रश्न 41.
2 लीटर जल में 25°C पर K2 SO4 के 25 mg को घोलने पर बनने वाले विलयन का परासरण दाब, यह मानते हुए ज्ञात कीजिए कि K2 SO4 पूर्णतः वियोजित हो गया है।
हल

परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
1 मोलल जलीय विलयन में विलेय का मोल प्रभाज है – (2017)
(1) 1
(ii) 1.8
(iii) 18
(iv) 0.018
उत्तर
(iv) 0.018
प्रश्न 2.
शुद्ध जल की मोलरता होती है – (2014, 16, 17)
(i) 55.56
(ii) 5.556
(iii) 0.18
(iv) 0.018
उत्तर
(i) 55.56
प्रश्न 3.
0.2 M H ,SO, विलयन की सान्द्रता ग्राम प्रति लीटर में होगी – (2017)
(i) 21.4
(ii) 39.2
(iii) 9.8
(iv) 19.6
उत्तर
(iv) 19.6
प्रश्न 4.
किसका वाष्प दाब न्यूनतम होगा? (2017)
(i) 0.1 M BaCl2 विलयन
(ii) 0.1 M फिनॉल विलयन
(iii) 0.1 M सुक्रोज विलयन
(iv) 0.1 M सोडियम क्लोराइड विलयन
उत्तर
(i) 0.1 M BaCl2 विलयन
प्रश्न 5.
दो द्रवों Pएवं ९ के वाष्पदाब क्रमशः 80 मिमी एवं 60 मिमी हैं। P के 3 मोल तथा Q के 2 मोल मिलाने पर प्राप्त विलयन का कुल वाष्पदाब होगा – (2014)
(i) 140 मिमी
(ii) 20 मिमी
(iii) 68 मिमी
(iv) 72 मिमी
उत्तर
(iv) 72 मिमी
प्रश्न 6.
निम्नलिखित में से कौन-सा अणुसंख्य गुणधर्म है? (2015)
(i) श्यानता।
(ii) परासरण दाब
(iii) प्रकाशिक घूर्णन
(iv) पृष्ठ तनाव
उत्तर
(ii) परासरण दाब
प्रश्न 7.
निम्नलिखित में से विलयन का कौन-सा भौतिक गुण अणुओं की संख्या पर निर्भर नहीं करता? (2018)
(i) वाह्य सह अवनमन
(ii) हिमांक अवनमन
(iii) पृष्ठ तनाव
(iv) परासरण दाब
उत्तर
(iii) पृष्ठ तनाव
प्रश्न 8.
निम्न में किसके जलीय विलयन का क्वथनांक सर्वाधिक होगा? (2017)
(i) 1% ग्लूकोस
(ii) 1% NaCl
(iii) 1% CaCl2
(iv) 1% सुक्रोस
उत्तर
(iii) 1% CaCl2
प्रश्न 9.
निम्न के 0.1 M जलीय मोलल विलयन में न्यूनतम हिमांक किसका है? (2009)
(i) पोटैशियम सल्फेट
(ii) सोडियम क्लोराइड
(iii) यूरिया
(iv) ग्लूकोस
उत्तर
(i) पोटैशियम सल्फेट
प्रश्न 10.
12.0 ग्राम यूरिया को 1 लीटर जल में घोला गया तथा 68.4 ग्राम सुक्रोज को 1 लीटर जल में घोला गया। यूरिया विलयन के वाष्पदाब का आपेक्षिक अवनमन होगा – (2012)
(i) सुक्रोज विलयन की अपेक्षा अधिक
(ii) सुक्रोज विलयन की अपेक्षा कम
(iii) सुक्रोज विलयन की अपेक्षा दोगुना
(iv) सुक्रोज विलयन के बराबर
उत्तर
(i) सुक्रोज विलयन की अपेक्षा अधिक।
प्रश्न 11.
किस सूत्र द्वारा मोलल उन्नयन स्थिरांक (KA) की गणना की जा सकती है? (2017)
(i)
(ii)
(iii)
(iv) इनमें से कोई नहीं
उत्तर
(i)
प्रश्न 12.
निम्नलिखित में से किसका परासरण दाब सबसे कम होता है ? (2010, 16)
(i) पोटैशियम क्लोराइड विलयन
(ii) स्वर्ण विलयन
(iii) मैग्नीशियम क्लोराइड विलयन
(iv) ऐलुमिनियम फॉस्फेट विलयन
उत्तर
(ii) स्वर्ण विलयन
प्रश्न 13.
किसी विलयन का परासरण दाब किस सम्बन्ध द्वारा प्रदर्शित किया जाता है? (2013)
(i) p =
(ii) p =
(ii) p =
(iv) = RT
उत्तर
(iv) = RT
प्रश्न 14.
निम्नलिखित विलयनों में सर्वाधिक परासरण दाब किसका है? (2014)
(i) 1 M KCl
(ii) 1 M (NH4)3PO4
(iii) 1 M BaCl2
(iv) 1 M C6H12O6
उत्तर
(ii) 1 M (NH4)3PO4
प्रश्न 15.
समान ताप पर किन विलयनों के युग्म समपरासरी हैं? (2012)
(i) 0.1 M NaCl तथा 0.1 M Na2SO4
(ii) 0.1 M यूरिया तथा 0.1 M NaCl
(iii) 0.1 M यूरिया तथा 0.2 M MgCl2
(iv) 0.1 M Ca(NO3)2 तथा 0.1 M Na2SO4
उत्तर
(iv) 0.1 M Ca(NO3)2 तथा 0.1 M Na2SO4
प्रश्न 16.
गन्ने की शक्कर (अणुभार 342) का 5% विलयन, पदार्थ x के 1% विलयन से समपरासरी है। पदार्थx का अणुभार है – (2013)
(i) 68.4
(ii) 171.2
(iii) 136.2
(iv) 34.2
उत्तर
(i) 68.4
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
किसी विलयन में विलेय तथा विलायक क्या होते हैं?
उत्तर
विलयन का वह अवयव जो द्रव्यमानानुसार अधिक मात्रा में उपस्थित होता है, विलायक कहलाता है जबकि दूसरा अवयव जो कम मात्रा में उपस्थित होता है, विलेय कहलाता है।
प्रश्न 2.
0.25 N ऑक्सैलिक अम्ल विलयन की मोलरता ज्ञात कीजिए।
[C = 12, O = 16, H = 1] (2009)
हल
ऑक्सैलिक अम्ल (COOH)2 का तुल्यांकी भार = 63
तथा अणुभार = 126
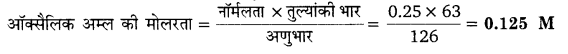
प्रश्न 3.
किसी पदार्थ का 1 मोल 500 मिली जल में घोला गया। विलयन की मोलरता की गणना कीजिए। (2017)
हल
मोलरता = = 2 M
प्रश्न 4.
100 ग्राम विलायक में विलेय का मोल घुला है। विलयन की मोललता ज्ञात कीजिए। (2017)
हल

प्रश्न 5.
H2SO4 का एक नमूना 94% (w/v) है और इसका घनत्व 1.84 ग्राम/मिली है। इस विलयन की मोललता ज्ञात कीजिए। [H = 1, 0 = 16, S = 32] (2017)
हल
100 मिली में H2SO4 का भार = 94 ग्राम
100 मिली नमूने का भार = आयतन x घनत्व = 100 x 1.84 = 184 ग्राम
नमूने में विलायक की मात्रा = 184 – 94 = 90 ग्राम = 0.09 किग्रा
तथा H2SO4 का अणु भार = 2 x 1 + 32 + 4 x 16 = 98

प्रश्न 6.
14.625 ग्राम सोडियम क्लोराइड को 250 ग्राम जल में विलेय किया गया। प्राप्त विलयन की मोललता की गणना कीजिए। [Na = 23, cl = 35.5] (2013)
हल
सोडियम क्लोराइड के ग्राम-अणुओं की संख्या

प्रश्न 7.
एक विलयन में 40 ग्राम NaOH को 500 mL जल में घोला गया है। इसकी मोलरता एवं नॉर्मलता की गणना कीजिए। (2017)
हल

NaOH विलयन की नॉर्मलता एवं मोलरता समान होगी क्योंकि इसका तुल्यांकी भार एवं अणुभार समान हैं।
प्रश्न 8.
राउल्ट का वाष्प दाब अवनमन नियम लिखिए। इसकी सीमाएँ भी लिखिए। (2009, 11, 16)
उत्तर
राउल्ट के नियम के अनुसार, “किसी विलयन के वाष्प-दाब का आपेक्षिक अवनमन विलेय पदार्थ के मोल प्रभाज के बराबर होता है।”
जहाँ, P तथा Ps क्रमशः विलायक तथा विलयन के वाष्प दाब हैं और n1 तथा n2 क्रमशः विलेय तथा विलायक के ग्राम-अणुओं की संख्या है।सीमाएँ–
- राउल्ट का नियम तनु विलयनों पर लागू होता है। सान्द्र विलयन राउल्ट के नियम से विचलन प्रदर्शित करते हैं।
- यह नियम केवल अवाष्पशील पदार्थों के विलयनों पर लागू होता है।
- वैद्युत-अपघट्यों के विलयनों पर राउल्ट का नियम लागू नहीं होता है।
- जो पदार्थ विलयनों में संगुणित हो जाते हैं, उन पदार्थों के विलयन भी राउल्ट के नियम का पालन नहीं करते हैं।
प्रश्न 9.
साधारणतया किसी विलायक में विलेय को घोलने पर उसका क्वथनांक बढ़ जाता है। क्यों ? उचित कारण दीजिए। (2011)
उत्तर
किसी विलायक में कोई अवाष्पशील पदार्थ घोलने पर विलयन का वाष्पदाब कम हो जाता है, जिसके परिणामस्वरूप विलयन का क्वथनांक बढ़ जाता है।
प्रश्न 10.
एक अवाष्पशील विलेय को किसी विलायक में मिलाने से उसका वाष्प दाब कम क्यों हो जाता है ? (2012)
उत्तर
किसी द्रव में उपस्थित अणु प्रत्येक दिशा में गतिशील रहते हैं। सतह के अणुओं की गतिज ऊर्जा अन्य अणुओं की अपेक्षा अधिक होती है; अतः ये अणु द्रव की सतह से वाष्प के रूप में पृथक् हो जाते हैं। अणुओं की यह प्रवृत्ति निर्गामी प्रवृत्ति कहलाती है। वाष्प के ये अणु सतह पर दाब डालते हैं, जिसको वाष्प दाब कहते हैं। किसी द्रव या विलायक में अवाष्पशील पदार्थ मिलाने पर द्रव के अणुओं की यह निर्गामी प्रवृत्ति घट जाती है; क्योंकि विलेय पदार्थ द्रव के अणुओं पर एक प्रकार का अवरोध उत्पन्न करता है; अत: द्रव का वाष्प दाब घट जाता है; इसलिए विलयन का वाष्प दाब विलायक के वाष्प दाब से सदा कम रहता है।
प्रश्न 11.
दो द्रवों A तथा B के वाष्प दाब क्रमशः 80 mm तथा 60 mm हैं। A के 3 मोल तथा B के 2 मोल मिलाने पर प्राप्त विलयन का कुल वाष्प दाब क्या होगा? (2017)
हल
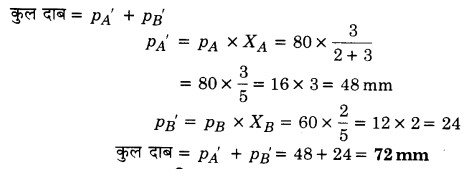
प्रश्न 12.
ग्राम-अणुक उन्नयन स्थिरांक तथा ग्राम अणुक अवनमन स्थिरांक को परिभाषित कीजिए। (2016)
उत्तर
ग्राम-अणुक उन्नयन स्थिरांक – किसी विलायक के 100 ग्रामों में किसी अवाष्पशील विलेय या वैद्युत-अन अपघट्य के एक ग्राम-अणु घोलने पर उसके क्वथनांक में जो उन्नयन होता है, वह उस विलायक का ग्राम-अणुक उन्नयन स्थिरांक कहलाता है। इसको K या K100 से व्यक्त करते हैं।
ग्राम-अणुक अवनमन स्थिरांक – किसी अवाष्पशील वैद्युत-अपघटय के 1 ग्राम-अणु (मोल) को 100 ग्राम विलायक में घोलने पर विलायक के हिमांक में जो अवनमन होता है, उसे विलायक का ग्राम-अणु अवनमन स्थिरांक कहते हैं।
प्रश्न 13.
12 ग्राम ग्लूकोज को 100 ग्राम जल में घोलने पर विलयन का क्वथनांक 100.34°Cपाया गया। ग्लूकोज के मोलल उन्नयन स्थिरांक की गणना कीजिए।
[C = 12, O = 16, H = 1] (2015, 16)
हल

प्रश्न 14.
6 ग्राम यूरिया को 200 ग्राम जल में घोलने पर प्राप्त विलयन का क्वथनांक 0.28°C है। इसी विलयन का हिमांक क्या होगा? जल का मोलल उन्नयन स्थिरांक एवं मोलल अवनमन स्थिरांक के मान क्रमशः 0.52°C मोलल-1 तथा 1.86 °C मोलल-1 हैं।
हल

प्रश्न 15.
वाण्ट-हॉफ गुणांक क्या है? 0.1 मोलल Ca(NO3)2 के विलयन के क्वथनांक की गणना कीजिए। जल के लिए kb = 0.52 K kg mol-1 (2015)
हल
वाण्ट-हॉफ गुणांक- वाण्ट-हॉफ गुणांक किसी पदार्थ के अणुसंख्य गुणधर्मों के प्रेक्षित तथा परिकलित या आपेक्षित मानों का अनुपात होता है।

प्रश्न 16.
परासरण क्या है ? परासरण दाब के लिए व्यंजक लिखिए। (2012, 14)
उत्तर
विलायक के अणुओं का अर्द्धपरासरण झिल्ली में होकर शुद्ध विलायक से विलयन की ओर या तनु विलयन से सीन्द्र विलयन की ओर स्वत: प्रवाह परासरण कहलाता है। परासरण दाब के लिए व्यंजक PV = nRT
जहाँ P = विलयन का परासरण दाब (वायुमण्डल में)
V = विलयन का आयतन (लीटर में)
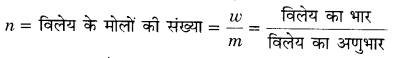
T = परमताप और R = विलयन स्थिरांक = 0.082 लीटर-वायु /डिग्री/मोल
प्रश्न 17.
परासरण तथा विसरण क्रिया में विभेद कीजिए। (2010)
उत्तर
परासरण क्रिया तथा विसरण क्रिया में अन्तर
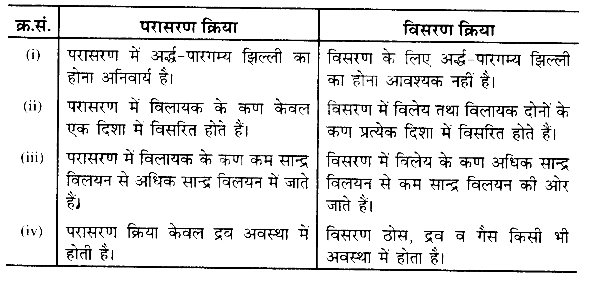
प्रश्न 18.
समपरासरी विलयन किसे कहते हैं? (2009)
उत्तर
ऐसे विलयन, जिनके परासरण दाब समान ताप पर समान हों, समपरासरी विलयन कहलाते हैं। दो समपरासरी विलयनों को अर्द्ध-पारगम्य झिल्ली द्वारा पृथक् करने पर परासरण नहीं होता है।
प्रश्न 19.
0.1 M ग्लूकोस तथा 0.1 M सोडियम क्लोराइड विलयन में किसका परासरण दाब अधिक होगा और क्यों? कारण सहित लिखिए। (2016)
उत्तर
इनमें 0.1 M सोडियम क्लोराइड का जलीय विलयन अधिक परासरण दाब प्रदर्शित करेगा; क्योंकि यह आयनन पर Na+ तथा Cl– दो आयन देता है, जबकि ग्लूकोस का आयनन नहीं होता है। परासरण दाब अणुसंख्य गुणधर्म का उदाहरण है। अणुसंख्य गुणधर्म आयनों की संख्या पर निर्भर करते हैं। अणुसंख्य गुणधर्म ० अणुओं की संख्या (इन गुणों में आयन अणुओं के समान व्यवहार करते हैं)।
प्रश्न 20.
27°C पर डेसी मोलर यूरिया विलयन का परासरण दाब ज्ञात कीजिए।
R = 0.082 ली०वायु०/डिग्री-मोल (2017)
हल
दिया गया है, T = 27 + 273 = 300 K, =
, P= ?, R= 0.0821
PV = n RT
P = RT
P = × 0.0821 × 300 = 0.0821×30 = 0.821 × 3
= 2.463 वायुमण्डल
लघु उत्तरीय प्रश्न
प्रश्न 1.
72 ग्राम जल और 92 ग्राम एथिल ऐल्कोहॉल के मिश्रण में दोनों का मोल-प्रभाज ज्ञात कीजिए। (2011)
हल

प्रश्न 2.
36 ग्राम जल और 46 ग्राम एथिल ऐल्कोहॉल मिश्रण में दोनों का मोल प्रभाज ज्ञात कीजिए। (2015)
हल

प्रश्न 3.
यूरिया का एक विलयन भारानुसार 6°० है। विलयन में यूरिया तथा जल का मोल प्रभाज ज्ञात कीजिए। (यूरिया का अणुभार = 60) (2017)
हल

प्रश्न 4.
एक सल्फ्यूरिक अम्ल विलयन की मोललता की गणना कीजिए जिसमें जल का मोल प्रभाज 0.85 है। (2015)
हल
जल का मोल प्रभाज = 0.85
H2SO4 का मोल प्रभाजे = 1 – 0.85 = 0.15

प्रश्न 5.
बेन्जीन के एक विलयन में I2 घुली है। विलयन में I2 का मोल प्रभाज 0.25 है। विलयन की मोललता ज्ञात कीजिए। (2017)
हल

प्रश्न 6.
शुद्ध बेन्जीन का किसी ताप पर वाष्पदाब 640 mm Hg है। एक अवाष्पशील विद्युत अपघटय ठोस जिसका भार 2.75 ग्राम है, 39 ग्राम बेन्जीन में डाला गया। विलयन का वाष्पदाब 600 mm Hg है। ठोस पदार्थ का अणुभार ज्ञात कीजिए। (2017)
हल
P0 = 640 mm Hg, Ps = 600 mm Hg, w = 2.75 ग्राम, w = 39 gram, m = ?
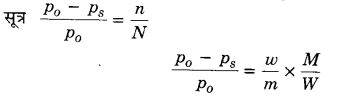
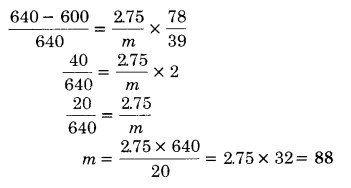
प्रश्न 7.
जब एक अवाष्पशील पदार्थ का 1.5 ग्राम 60 ग्राम जल में घोला जाता है तो उसका हिमांक 0.136°C कम हो जाता है। पदार्थ के अणुभार की गणना कीजिए। (जल का मोलल अवनमन स्थिरांक = 1.86°C) (2017)
हल

प्रश्न 8.
चीनी का जल में बना एक 5% (भारानुसार) विलयन का हिमांक 271 K है। ग्लूकोस के जल में बने 5% विलयन के हिमांक की गणना कीजिए, यदि शुद्ध जल का हिमांक 273.15 K है। (2015)
हल

प्रश्न 9.
27°C पर 2% यूरिया विलयन का परासरण दाब ज्ञात कीजिए।(विलयन स्थिरांक= 0.082 ली-वायु/डिग्री/मोल) (2016)
हल
प्रश्नानुसार, R= 0.082, T = 27 + 273 = 300 K
यूरिया का अणुभार = 60
∴ 2 ग्राम यूरिया विलयन का आयतन = 100 मिली
∴ 60 ग्राम (1 मोल) यूरिया विलयन का आयतन = x 60 = 3000 मिली
= 3 लीटर
सूत्रानुसार, परासरण दाब (P) = =
= 8.2 वायुमण्डल
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
एक ठोस की किसी द्रव में विलेयता को प्रभावित करने वाले कारकों का वर्णन कीजिए।
उत्तर
एक ठोस की किसी द्रव में विलेयता मुख्य रूप से निम्नलिखित कारकों पर निर्भर करती है –
1. विलेय तथा विलायक की प्रकृति – सामान्यतः एक ठोस रासायनिक रूप से समान द्रव में घुलता है। इसे इस प्रकार कह सकते हैं कि समान-समान को घोलता है (like dissolves like)। इससे स्पष्ट है कि NaCl जैसे आयनिक (ध्रुवीय) यौगिक जल जैसे ध्रुवीय विलायकों में घुल जाते हैं जबकि बेंजीन, ईथर आदि अध्रुवीय विलायकों में बहुत कम विलेय या लगभग अविलेय होते हैं। इसी प्रकार नैफ्थलीन, एन्थ्रासीन आदि अध्रुवीय (सहसंयोजक) यौगिक बेंजीन, कार्बन टेट्राक्लोराइड, ईथर आदि अध्रुवीय (सहसंयोजक) विलायकों में आसानी से घुल जाते हैं जबकि ये जल जैसे ध्रुवीय विलायकों में बहुत कम घुलते हैं।
यही कारण है कि साधारण नमक (सोडियम क्लोराइड) चीनी की तुलना में जल में अधिक विलेय होता है। उनकी जल में विलेयताएँ क्रमश: 5.3 मोल प्रति लीटर तथा 3.8 मोल प्रति लीटर हैं।
2. ताप– किसी विलायक में एक ठोस की विलेयता पर ताप का प्रभाव इस बात पर निर्भर करता है कि घुलन प्रक्रिया ऊष्माक्षेपी (exothermic) है अथवा ऊष्माशोषी (endothermic)। इसे आसानी से लाशातेलिए सिद्धान्त (Le-Chatelier’s principle) के आधार पर निम्न प्रकार से समझा जा सकता है –
(i) जब कोई पदार्थ ऊष्मा अवशोषण के साथ घुलता है तो ताप में वृद्धि करने पर उसकी विलेयता में सतत् वृद्धि होती है। माना कि एक पदार्थ AB जल में निम्न साम्य स्थापित करता है –
AB(s) + aq AB (aq) + ऊष्मा
ला-शातेलिए सिद्धान्त के अनुसार, ताप में वृद्धि करने पर साम्य दाईं ओर विस्थापित हो जाता है। और इस प्रकार ताप में वृद्धि करने पर पदार्थ की विलेयता में वृद्धि हो जाती है।
NaNO3 KNO3 NaCl, KCl आदि ऐसे पदार्थों के उदाहरण हैं।
(ii) जब कोई पदार्थ ऊष्मा उत्सर्जन के साथ घुलित होता है तो ताप में वृद्धि होने पर उसकी विलेयता निरन्तर घटती है। माना कि एक पदार्थ AB जल में निम्न साम्य स्थापित करता है –
AB(s) + aq AB (aq) – ऊष्मा
ला-शातेलिए सिद्धान्त के अनुसार, ताप में वृद्धि करने पर साम्य को उस दिशा में विस्थापित होना चाहिए जिस दिशा में यह उत्पन्न ऊष्मा के प्रभाव को समाप्त कर सके। स्पष्ट है कि ताप में वृद्धि करने पर साम्य बायीं ओर विस्थापित होगा और पदार्थ की विलेयता कम हो जाएगी। सीरियम सल्फेट, लीथियम कार्बोनेट, सोडियम काबॉनेट मोनोहाइड्रेट ऐसे पदार्थों के उदाहरण हैं।
उपरोक्त पदार्थों (जिनकी विलेयता ताप वृद्धि के साथ निरन्तर घटती या बढ़ती है) के अतिरिक्त एक अन्य प्रकार के पदार्थ भी ज्ञात हैं। इनकी विलेयता ताप वृद्धि के साथ निरन्तर घटती या बढ़ती नहीं है। ये पदार्थ एक निश्चित ताप पर अपने एक रूप से दूसरे रूप में परिवर्तित हो जाते हैं। यह तापे संक्रमण ताप (transition temperature) कहलाता है। रूपों में यह परिवर्तन एक बहुरूपी रूप से दूसरे बहुरूपी रूप में (अमोनियम नाइट्रेट का से 8 रूप में) अथवा एक जलयोजित रूप से दूसरे जलयोजित रूप में (CaCl2.6H2O → CaCl2 . 4H2O) अथवा जलयोजित रूप से अनार्द्र रूप में (Na2SO4 . 10H2O → Na2SO4) हो सकता है। रूपों में इस प्रकार के परिवर्तन के कारण ही सोडियम सल्फेट की विलेयता पहले 32.4°C तक बढ़ती है और उसके पश्चात् घटने लगती है।
Na2SO4. 10H2O Na2SO4
We hope the UP Board Solutions for Class 12 Chemistry Chapter 2 Solutions (विलयन) help you.