UP Board Solutions for Class 12 Chemistry Chapter 3 Electro Chemistry (वैद्युत रसायन)
UP Board Solutions for Class 12 Chemistry Chapter 3 Electro Chemistry (वैद्युत रसायन)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
निकाय Mg2+ | Mg का मानक इलेक्ट्रोड विभव आप किस प्रकार ज्ञात करेंगे?
उत्तर
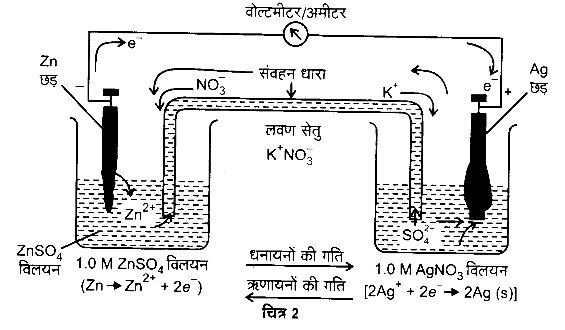
निकाय Mg2+ | Mg का मानक इलेक्ट्रोड विभव ज्ञात करने के लिए एक सेल स्थापित करते हैं। जिसमें एक इलेक्ट्रोड Mg | MgSO4 (1M), एक मैग्नीशियम के तार को 1M MgSO4 विलयन में डुबोकर व्यवस्थित करते हैं तथा मानक हाइड्रोजन इलेक्ट्रोड Pt, H2 (1 atm) | H+ (1M) को दूसरे इलेक्ट्रोड की भाँति व्यवस्थित करते हैं (चित्र-1)।
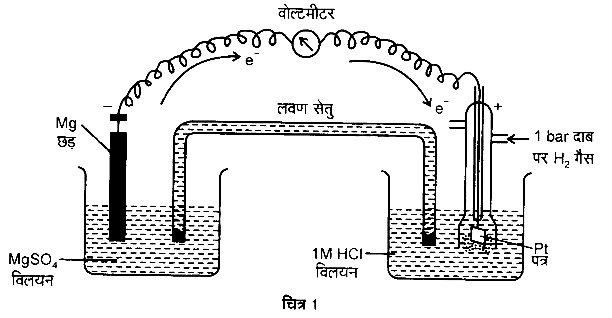
सेल का विद्युत वाहक बल मापते हैं तथा वोल्टमीटर में विक्षेप की दिशा को भी नोट करते हैं। विक्षेप की दिशा प्रदर्शित करती है कि इलेक्ट्रॉनों को प्रवाह मैग्नीशियम इलेक्ट्रोड से हाइड्रोजन इलेक्ट्रोड की ओर है। अर्थात् मैग्नीशियम इलेक्ट्रोड पर ऑक्सीकरण तथा हाइड्रोजन इलेक्ट्रोड पर अपचयन होता है। अत: सेल को निम्नवत् व्यक्त किया जा सकता है –
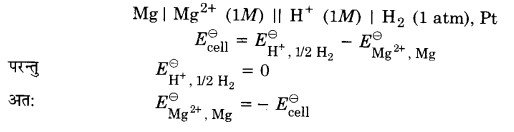
प्रश्न 2.
क्या आप एक जिंक के पात्र में कॉपर सल्फेट का विलयन रख सकते हैं?
उत्तर
![]()
अब हम यह जाँच करेंगे कि निम्नलिखित अभिक्रिया होगी अथवा नहीं।
Zn(s)+ CuSO4(aq) → ZnSO4(aq) + Cu(s)
सेल को इस प्रकार प्रदर्शित किया जा सकता है –
Zn | Zn2+ || Cu2+ | Cu
![]()
= 0.34 V – (- 0.76V) = 1.1 V
चूंकि E–cell धनात्मक है, अत: अभिक्रिया होगी तथा इस कारण हम जिंक के पात्र में कॉपर सल्फेट नहीं रख सकते हैं।
प्रश्न 3.
मानक इलेक्ट्रोड विभव की तालिका का निरीक्षण कर तीन ऐसे पदार्थ बताइए जो अनुकूल परिस्थितियों में फेरस आयनों को ऑक्सीकृत कर सकते हैं।
उत्तर
फेरस आयनों के ऑक्सीकरण का अर्थ है –
Fe2+ → Fe3+ + e– ; E– =- 0.77 V
केवल वे पदार्थ Fe2+ को Fe3+ में ऑक्सीकृत कर सकते हैं जो प्रबल ऑक्सीकारक हों तथा जिनका धनात्मक अपचायक विभव 0.77 V से अधिक हो जिससे सेल अभिक्रिया का विद्युत वाहक बल धनात्मक प्राप्त हो सके। यह स्थिति उन तत्वों पर लागू हो सकती है जो विद्युत-रासायनिक श्रेणी में Fe3+ | Fe2+ से नीचे स्थित हैं; उदाहरणार्थ- Br, Cl तथा I.
प्रश्न 4.
pH = 10 के विलयन के सम्पर्क वाले हाइड्रोजन इलेक्ट्रोड के विभव का परिकलन कीजिए।
हल
हाइड्रोजन इलेक्ट्रोड के लिए,
H+ + e– → 1/2 H2
नेर्नुस्ट समीकरण से,
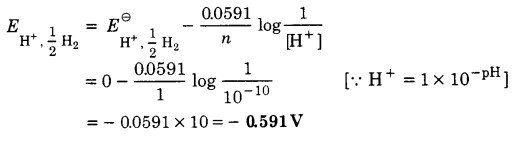
प्रश्न 5.
एक सेल के emf का परिकलन कीजिए जिसमें निम्नलिखित अभिक्रिया होती है। दिया गया है: E–cell = 1.05 V
Ni(s) + 2Ag+ (0.002M) → Ni2+ (0.160M) + 2Ag(s)
हल
दी गई सेल अभिक्रिया के लिए नेस्ट समीकरण से,
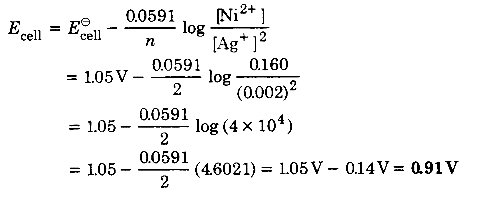
प्रश्न 6.
एक सेल जिसमें निम्नलिखित अभिक्रिया होती है –
2Fe3+ (aq) + 2I– (aq) → 2Fe2+ (aq) + I(s)
का 298K ताप पर E–cell = 0.236 V है। सेल अभिक्रिया की मानक गिब्ज ऊर्जा एवं साम्य स्थिरांक का परिकलन कीजिए।
हल
2Fe3+ + 2e– → 2Fe2+
2I– → I2 + 2e–
अतः दी गई सेल अभिक्रिया के लिए, n = 2
ΔrG– = – nFE–cell
= – 2 x 96500 x 0.236 J
= -45.55 kJ mol-1
ΔrG– = -2.303 RT log KC

= 7.983
KC = Antilog (7.983) = 9.616 x 107
प्रश्न 7.
किसी विलयन की चालकता तनुता के साथ क्यों घटती है?
उत्तर
विलयन की चालकता, विलयन के एकांक आयतन में उपस्थित आयनों की चालकता होती है। तनुकरण पर प्रति एकांक आयतन आयनों की संख्या घटती है, अत: चालकता भी घट जाती है।
प्रश्न 8.
जल की Δºm ज्ञात करने का एक तरीका बताइए।
उत्तर
अनन्त तनुता पर जल की सीमान्त मोलर चालकता (Δºm), अनन्त तनुता पर सोडियम हाइड्रॉक्साइड, हाइड्रोक्लोरिक अम्ल तथा सोडियम क्लोराइड (जिसमें सभी प्रबल विद्युत-अपघट्य हैं) की मोलर चालकताएँ ज्ञात होने पर निम्न प्रकार प्राप्त की जा सकती है –
Δºm (H2O ) = Δºm (NaOH) + Δºm HCl – Δºm (NaCl)
प्रश्न 9.
0.025 mol L-1 मेथेनोइक अम्ल की चालकता 46.1 S cm2 mol-1 है। इसकी वियोजन की मात्रा एवं वियोजन स्थिरांक का परिकलन कीजिए। दिया गया है कि
λ°(H+) = 349.6S cm mol-1 एवं
λ°(HCOO-) = 54.6 S cm mol-1.
हल

प्रश्न 10.
यदि एक धात्विक तार में 0.5 ऐम्पियर की धारा 2 घंटों के लिए प्रवाहित होती है तो तार में से कितने इलेक्ट्रॉन प्रवाहित होंगे?
हल
Q (कूलॉम) = i (ऐम्पियर) × t (सेकण्ड)
= (0.5 ऐम्पियर) × (2 × 60 x 60 s) = 3600 C
96500 C का प्रवाह 1 मोल इलेक्ट्रॉन अर्थात् 6.02 x 1023 इलेक्ट्रॉनों के प्रवाह के तुल्य होता है।
3600 C के तुल्य इलेक्ट्रॉनों का प्रवाह =
= 2246 x 1022 इलेक्ट्रॉन
प्रश्न 11.
उन धातुओं की एक सूची बनाइए जिनका विद्युत-अपघटनी निष्कर्षण होता है।
उत्तर
Na, Ca, Mg तथा Al.
प्रश्न 12.
निम्नलिखित अभिक्रिया में Cr2O72- आयनों के एक मोल के अपचयन के लिए कूलॉम में विद्युत की कितनी मात्रा की आवश्यकता होगी ?
Cr2O72- + 14H+ + 6e → 2Cr3++ + 7H2O
हल
दी गई अभिक्रिया के अनुसार,
Cr2O72- – आयनों के एक मोल को 6 मोल इलेक्ट्रॉनों की आवश्यकता होती है।
अतः F = 6 x 96500 C = 579000 C
अत: Cr3+ में अपचयन के लिए 579000 C विद्युत की आवश्यकता होगी।
प्रश्न 13.
चार्जिंग के दौरान प्रयुक्त पदार्थों का विशेष उल्लेख करते हुए लेड संचायक सेल की चार्जिंग क्रियाविधि का वर्णन रासायनिक अभिक्रियाओं की सहायता से कीजिए।
उत्तर
चार्जिग (आवेशन) के दौरान एक बाह्य स्रोत से सेल को विद्युत ऊर्जा दी जाती है अर्थात् सेल एक विद्युतअपघटनी सेल की भाँति कार्य करता है। अभिक्रियाएँ डिस्चार्ज (निरावेशन) के दौरान होने वाली अभिक्रियाओं से विपरीत प्रकार होती हैं।

प्रश्न 14.
हाइड्रोजन को छोड़कर ईंधन सेलों में प्रयुक्त किए जा सकने वाले दो अन्य पदार्थ सुझाइए।
उत्तर
मेथेन (CH4), मेथेनॉल (CH3OH)।
प्रश्न 15.
समझाइए कि कैसे लोहे पर जंग लगने का कारण एक विद्युत-रासायनिक सेल बनना माना जाता है?
उत्तर
लोहे की सतह पर उपस्थित जल की परत वायु के अम्लीय ऑक्साइडों; जैसे- CO2, SO2 आदि को घोलकर अम्ल बना लेती है जो वियोजित होकर H+ आयन देते हैं
H2O+ CO2 → H2CO3 2H+ +CO32-
H+ आयनों की उपस्थिति में, लोहा कुछ स्थलों पर से इलेक्ट्रॉन खोना प्रारम्भ कर देता है तथा फेरस आयन बना लेता है। अतः ये स्थल ऐनोड का कार्य करते हैं –
Fe(s) → Fe2+ (aq) + 2e–
इस प्रकार धातु से उत्सर्जित इलेक्ट्रॉन अन्य स्थलों पर पहुँच जाते हैं जहाँ H+ आयन तथा घुली हुई ऑक्सीजन इन इलेक्ट्रॉनों को ग्रहण कर लेती है तथा अपचयन अभिक्रिया हो जाती है। अतः ये स्थल कैथोड की भाँति कार्य करते हैं –
O2(g) +4H+ (aq) +4e– → 2H2O(l)
सम्पूर्ण अभिक्रिया इस प्रकारे दी जाती है
2Fe(s)+O2(g) + 4H+ (aq) → 2Fe2+ (aq) + 2H2O(l)
इस प्रकार लोहे की सतह पर विद्युत-रासायनिक सेल बन जाता है।
फेरस आयन पुनः वायुमण्डलीय ऑक्सीजन द्वारा ऑक्सीकृत होकर फेरिक आयनों में परिवर्तित हो जाते हैं। जो जल अणुओं से संयुक्त होकर जलीय फेरिक ऑक्साइड Fe2O3. xH2O बनाते हैं। यह जंग कहलाता है।
अतिरिक्त अभ्यास
प्रश्न 1.
निम्नलिखित धातुओं को उस क्रम में व्यवस्थित कीजिए जिसमें वे एक-दूसरे को उनके | लवणों के विलयनों में से प्रतिस्थापित करती हैं।
Al, Cu, Fe, Mg एवं Zn.
उत्तर
Mg, Al, Zn, Fe तथा Cu
प्रश्न 2.
नीचे दिए गए मानक इलेक्ट्रोड विभवों के आधार पर धातुओं को उनकी बढ़ती हुई अपचायक क्षमता के क्रम में व्यवस्थित कीजिए।
K+ । K = -2.93 V, Ag+ | Ag= 0.80V,
Hg2+ | Hg= 0.79 V
Mg2+ | Mg = -2.37 V, Cr3+ | Cr = -0.74 V
उत्तर
किसी धातु की अपचायक शक्ति उसके ऑक्सीकरण विभव पर निर्भर करती है। ऑक्सीकरण विभव जितना अधिक होगा, ऑक्सीकृत होने की प्रवृत्ति उतनी अधिक होगी तथा इसलिए उसकी अपचायक शक्ति भी उतनी ही अधिक होगी। अत: दिये गये धातुओं की बढ़ती अपचायक शक्ति का क्रम निम्न होगा –
Ag < Hg < Cr < Mg < K
प्रश्न 3.
उस गैल्वेनी सेल को दर्शाइए जिसमें निम्नलिखित अभिक्रिया होती है –
Zn(s) + 2Ag+ (aq) → Zn2+ (aq) + 2Ag(s)
अब बताइए –
- कौन-सा इलेक्ट्रोड ऋणात्मक आवेशित है?
- सेल में विद्युत-धारा के वाहक कौन-से हैं?
- प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रिया क्या है?
उत्तर
जिंक इलेक्ट्रोड ऐनोड का कार्य करता है, जबकि सिल्वर इलेक्ट्रोड कैथोड का कार्य करता है। सेल को निम्न प्रकार प्रदर्शित कर सकते हैं –
Zn (S)| Zn2+ (aq)|| Ag+ (aq)| Ag (s)
- Zn / Zn2+ इलेक्ट्रोड ऋणात्मक आवेशित होता है तथा ऐनोड की तरह कार्य करता है।
- बाह्य परिपथ में इलेक्ट्रॉन तथा आंतरिक परिपथ में आयन।
- ऐनोड पर : Zn (s) → Zn2+ (aq) + 2e–
कैथोड पर : Ag+ (aq) + e– → Ag(s)
प्रश्न 4.
निम्नलिखित अभिक्रियाओं वाले गैल्वेनी सेल का मानक सेल-विभव परिकलित कीजिए।
(i) 2Cr(s) + 3Cd2+ (aq) → 2Cr3+ (aq) + 3Cd
(ii) Fe2+ (aq) + Ag+ (aq) → Fe3+ (aq) + Ag(s)
उपर्युक्त अभिक्रियाओं के लिए ΔrG– एवं साम्य स्थिरांकों की भी गणना कीजिए।
हल
(i) सेले को निम्न प्रकार प्रदर्शित किया जा सकता है –


प्रश्न 5.
निम्नलिखित सेलों की 298K पर नेर्नुस्ट समीकरण एवं emf लिखिए।
- Mg(s) | Mg2+ (0001 M) || Cu2+ (0.0001 M) | Cu(s)
- Fe(s) | Fe2+ (0.001 M) || H+ (1 M) | H2(g) (1 bar) | Pt(s)
- Sn(8) | Sn2+ (0.050 M) | H+ (0.020 M) | H2(g) (1 bar) | Pt(s)
- Pt(s) | Br– (0.010 M)|Br2 (l) || H+ (0.030 M) | H2(g) (1 bar) | Pt (s).
हल
1. सेल अभिक्रिया निम्न प्रकार है –
Mg(s) + Cu2+ (0.0001 M) → Mg2+ (0.001 M) + Cu (s)
इसलिए n = 2,
इसके अनुसार नेर्नस्ट समीकरण निम्नवत् होगी –

2. सेल अभिक्रिया निम्न है –
Fe(s) + 2H+ (1M)→ Fe2+ (0.001M)+ H2 (1bar)
इसलिए n = 2,
इस सेल के epf के लिए नेर्नस्ट समीकरण निम्न होगी –

3. सेल अभिक्रिया निम्न है –
Sn(s) + 2H+ (0.020M) → Sn2+ (0.050M)+ H2 (1 bar)
इसलिए n = 2,
इसके अनुसार, नेर्नस्ट समीकरण निम्न होगी –
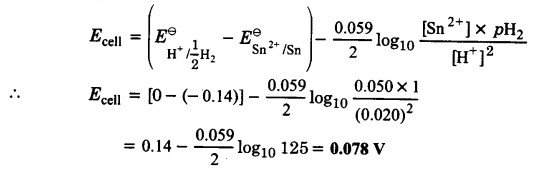
4. सेल अभिक्रिया निम्न है –
2Br– (0.010 M) + 2H+ (0.030 M) → Br2(l) + H2 (1 bar)
इसलिए n = 2,
सेल के लिए नेर्नस्ट समीकरण के अनुसार emf निम्न है –

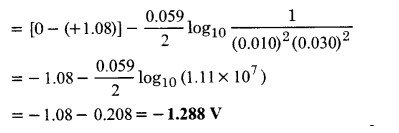
प्रश्न 6.
घड़ियों एवं अन्य युक्तियों में अत्यधिक उपयोग में आने वाली बटन सेलों में निम्नलिखित अभिक्रिया होती है –
Zn(s) + Ag2O(s) + H2O(l) → Zn2+ (aq) + 2Ag(s) + 2OH– (aq)
अभिक्रिया के लिए ΔrG– एवं E– ज्ञात कीजिए।
हल
![]()
सेल अभिक्रिया के लिए, n = 2
∴ ΔrG– = – nFE–cell
∴ ΔrG– = – 2 x 96500 x 1.104 = -2.13 x 105 CV mol-1
= – 2.13 x 10 J mol-1
प्रश्न 7.
किसी विद्युत-अपघट्य के विलयन की चालकता एवं मोलर चालकता की परिभाषा दीजिए। सान्द्रता के साथ इनके परिवर्तन की विवेचना कीजिए।
उत्तर
विद्युत-अपघट्य के विलयन की चालकता (Conductivity of the solution of an electrolyte) – यह प्रतिरोध R का व्युत्क्रम होती है तथा इसे उस सरल रूप में परिभाषित किया जा सकता है जिससे धारा किसी चालक में प्रवाहित होती है।
c =
k =
यहाँ k विशिष्ट चालकता है। चालकता का SI मात्रक सीमेन्ज (Siemens) है जिसे प्रतीक ‘S’ से निरूपित किया जाता है तथा यह ohm-1 या Ω-1 के तुल्य होता है।
मोलर चालकता (Molar conductivity) – वह चालकता जो 1 मोल विद्युत-अपघट्य को विलयन में घोलने पर समस्त आयनों द्वारा दर्शायी जाती है, मोलर चालकता कहलाती है, इसे Δm (लैम्ब्डा) से व्यक्त किया जाता है। यदि विद्युत-अपघट्य विलयन के V cm3 में विद्युत-अपघट्य के 1 mol उपस्थित हों, तब
Δm = K x V

इसकी इकाई ohm-1 cm2 mol-1 या S cm2 mol-1 है।
सान्द्रता के साथ चालकता तथा मोलर चालकता में परिवर्तन
(Variation of Conductivity and Molar Conductivity with Concentration)
विद्युत-अपघट्य की सान्द्रता में परिवर्तन के साथ-साथ चालकता एवं मोलर चालकता दोनों में परिवर्तन होता है। दुर्बल एवं प्रबल दोनों प्रकार के विद्युत-अपघट्यों की सान्द्रता घटाने पर चालकता सदैव घटती है। इसकी इस तथ्य से व्याख्या की जा सकती है कि तनुकरण (dilution) करने पर प्रति इकाई आयतन में विद्युत धारा ले जाने वाले आयनों की संख्या घट जाती है। किसी भी सान्द्रता पर विलयन की चालकता उस विलयन के इकाई आयतन का चालकत्व होता है जिसे परस्पर इकाई दूरी पर स्थित एवं इकाई अनुप्रस्थ काट क्षेत्रफल वाले दो प्लैटिनम इलेक्ट्रोडों के मध्य रखा गया हो।
यह निम्नलिखित समीकरण से स्पष्ट है –
C = =k
(A एवं । दोनों ही उपयुक्त इकाइयों m या cm में हैं)
किसी दी गई सान्द्रता पर एक विलयन की मोलर चालकता उस विलयन के V आयतन का चालकत्व है जिसमें विद्युत-अपघट्य का एक मोल घुला हो तथा जो एक-दूसरे से इकाई दूरी पर स्थित, A अनुप्रस्थ काट क्षेत्रफल वाले दो इलेक्ट्रोडों के मध्य रखा गया हो। अतः
Δm = = k
चूंकि l = 1 एवं A = V (आयतन, जिसमें विद्युत अपघट्य का एक मोल घुला है।)
Δm = k V
सान्द्रता घटने के साथ मीलर चालकता बढ़ती है। ऐसा इसलिए होता है क्योंकि वह कुल आयतन (V) भी बढ़ जाता है जिसमें एक मोल विद्युत अपघट्य उपस्थित होता है। यह पाया गया है कि विलयन के तनुकरण पर आयतन में वृद्धि K में होने वाली कमी की तुलना में कहीं अधिक होती है।
प्रबल विद्युत-अपघट्य (Strong Electrolytes)
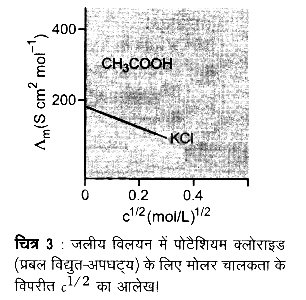
प्रबल विद्युत अपघट्यों के लिए Δm का मान तनुता के साथ धीरे-धीरे बढ़ता है एवं इसे निम्नलिखित समीकरण द्वारा निरूपित किया जा सकता है –
Δm = Δºm – Ac1/2
यह देखा जा सकता है कि यदि Δm को c1/2 के विपरीत आरेखित किया जाए (चित्र-3) तो हमें एक सीधी रेखा प्राप्त होती है जिसका अन्त:खण्ड A एवं ढाल ‘A’ के बराबर है। दिए गए विलायक एवं ताप पर स्थिरांक ‘A का मान विद्युत-अपघट्य के प्रकार अर्थात् विलयन में विद्युत-अपघट्य के वियोजन से उत्पन्न धनायन एवं ऋणायन के आवेशों पर निर्भर करता है। अत: NaCl, CaCl2, MgSO4 क्रमशः 1-1, 2-1 एवं 2-2 विद्युत-अपघट्य के रूप में जाने जाते हैं। एक प्रकार के सभी विद्युत-अपघट्यों के लिए ‘A’ का मान समान होता है।
प्रश्न 8.
298 K पर 0.20 M KCl विलयन की चालकता 0.0248 S cm-1 है। इसकी मोलर चालकता का परिकलन कीजिए।
हल
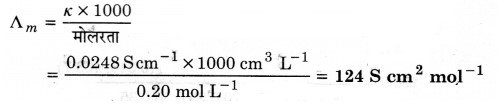
प्रश्न 9.
298 K पर एक चालकता सेल जिसमें 0.001 M KCl विलयन है, का प्रतिरोध 1500 Ω है। यदि 0.001 M KCl विलयन की चालकता 298K पर 0.146 x 10-3 S cm-1 हो तो सेल स्थिरांक क्या है?
हल
k = x सेल नियतांक
∴ सेल नियतांक = K R= 0.146 x 10-3 x 1500 = 0.219 cm-1
प्रश्न 10.
298 K पर सोडियम क्लोराइड की विभिन्न सान्द्रताओं पर चालकता का मापन किया गया जिसके आँकड़े अग्रलिखित हैं –

हल

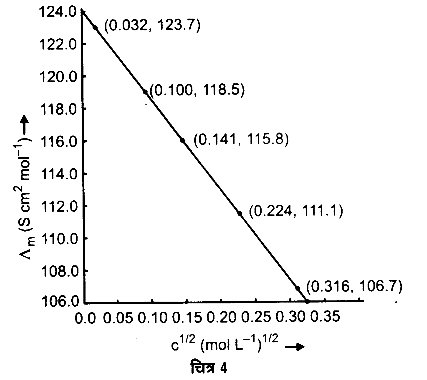
सीधी रेखा को पीछे तक खींचने पर यह Δm अक्ष पर 124.0 S cm2 mol-1 पर मिलती है। यह Δºm का मान है।
प्रश्न 11.
0.00241 M ऐसीटिक अम्ल की चालकता 7.896 x 10-5 S cm-1 है। इसकी मोलर चालकता को परिकलित कीजिए। यदि ऐसीटिक अम्ल के लिए Δºm का मान 390.5 S cm2 mol-1 हो तो इसका वियोजन स्थिरांक क्या है?
हल
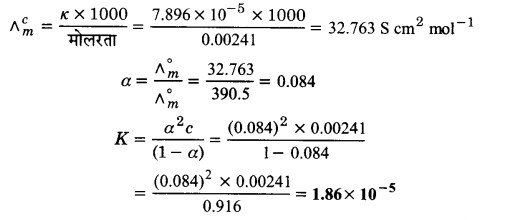
प्रश्न 12.
निम्नलिखित के अपचयन के लिए कितने आवेश की आवश्यकता होगी?
(i) 1 मोल Al3+ को Al में
(ii) 1 मोल Cu2+ को Cu में।
(iii) 1 मोल MnO–4 को Mn2+ में
हल

प्रश्न 13.
निम्नलिखित को प्राप्त करने में कितने फैराडे विद्युत की आवश्यकता होगी?
(i) गलित CaCl2 से 20.0 g Ca
(ii) गलित Al2O3 से 40.0 g Al
हल

प्रश्न 14.
निम्नलिखित को ऑक्सीकृत करने के लिए कितने कूलॉम विद्युत आवश्यक है?
- 1 मोल H2O को O2 में।
- 1 मोल FeO को Fe2O3 में।
हल
1. 1 mol H2O के लिए इलेक्ट्रोड अभिक्रिया इस प्रकार दी जाती है –
H2O → H2 + 1/2 O2
अर्थात् O2- → 1/2 O2 + 2e–
∴ आवश्यक विद्युत की मात्रा = 2F = 2 x 96500 C = 193000 C
2. 1 mol FeO के लिए इलेक्ट्रोड अभिक्रिया इस प्रकार दी जाती है –
FeO → 1/2 Fe2O3
अर्थात् Fe2+ → Fe3+ + e–
∴ आवश्यक विद्युत की मात्रा = 1F = 96500 C
प्रश्न 15.
Ni(NO3)2 के एक विलयन का प्लैटिनम इलेक्ट्रोडों के बीच 5 ऐम्पियर की धारा प्रवाहित करते हुए 20 मिनट तक विद्युत-अपघटन किया गया। Ni की कितनी मात्रा कैथोड पर निक्षेपित होगी?
हल
अभिक्रिया निम्न प्रकार सम्पन्न होती है –
Ni2+ + 2e– → Ni
Ni का परमाणु भार = 58.70

प्रश्न 16.
ZnSO4, AgNO3 एवं CuSO4 विलयन वाले तीन विद्युत-अपघटनी सेलों A, B, C को श्रेणीबद्ध किया गया एवं 1.5 ऐम्पियर की विद्युत धारा, सेल B के कैथोड पर 145 सिल्वर निक्षेपित होने तक लगातार प्रवाहित की गई। विद्युत धारो कितने समय तक प्रवाहित हुई? निक्षेपित कॉपर एवं जिंक को द्रव्यमान क्या होगा ?
हल

प्रश्न 17.
तालिका 3.1 (पाठ्यपुस्तक) में दिए गए मानक इलेक्ट्रोड विभवों की सहायता से अनुमान लगाइए कि क्या निम्नलिखित अभिकर्मकों के बीच अभिक्रिया सम्भव है?
(i) Fe3+ (aq) और I– (aq)
(ii) Ag+ (aq) और Cu (s)
(iii) Fe3+ (aq) और Br– (aq)
(iv) Ag (s) और Fe3+ (aq)
(v) Br2(aq) और Fe2+ (aq).
उत्तर



प्रश्न 18.
निम्नलिखित में से प्रत्येक के लिए विद्युत-अपघटन से प्राप्त उत्पाद बताइए –
- सिल्वर इलेक्ट्रोडों के साथ AgNO3 का जलीय विलयन
- प्लैटिनम इलेक्ट्रोडों के साथ AgNO3 का जलीय विलयन
- प्लैटिनम इलेक्ट्रोडों के साथ H2SO4 का तनु विलयन
- प्लैटिनम इलेक्ट्रोडों के साथ CuCl2 का जलीय विलयन।
उत्तर
1. AgNO3 (aq) → Ag+ (aq) + NO–3 (aq)
H2O H+ + OH–
कैथोड पर : चूंकि सिल्वर का अपचयन विभव (+0.80 V) जल (-0.830 V) से अधिक है, इसलिए Ag+ वरीयता के आधार पर अपचयित होगा तथा सिल्वर धातु कैथोड पर जमा होगी।
Ag+ (aq) + e– → Ag (s)
ऐनोड पर : निम्न अभिक्रिया होगी –
H2O (l) → 1/2 O2(g) + 2H+ (aq)
NO–3 (aq) → NO3 + e–
Ag(s) → Ag+ (aq) + e–
इन अभिक्रियाओं में कॉपर का अपचयन विभव न्यूनतम है। इसलिए सिल्वर स्वयं ऐनोड पर ऑक्सीकरण के फलस्वरूप Ag’ में परिवर्तित हो जायेगी और Ag’ आयन विलयन में चले जायेंगे।
Ag(s) → Ag+ (aq) + e–
2. कैथोड पर : सिल्वर आयने अपचयित होंगे तथा सिल्वर धातु जमा होगी।
ऐनोड पर : चूँकि जल का अपचयन विभव NO–3 आयनों से कम होता है, इसलिए जल वरीयता के आधार पर ऑक्सीकृत होगा तथा ऑक्सीजन मुक्त होगी।
H2O (l) → 1/2 O2 (g) + 2H+ (aq) + 2e–
3. प्लैटिनम इलेक्ट्रोडों के साथ H2SO4 के तनु विलयन का विद्युत-अपघटन
H2SO4(aq) → 2H+ (aq) + SO2-4 (aq)
H2O H+ + OH–
कैथोड पर : H+ +e– → H
H → H2 (g)
ऐनोड पर : OH– → OH + e–
4OH → 2H2O (l) + O2 (g)
अत: कैथोड पर H, तथा ऐनोड पर 0 मुक्त होगी।
4. CuCl2 (aq) → Cu2+ (aq) + 2Cl– (aq)
H2O H+ + OH–
कैथोड पर : चूंकि Cu2+ (+0.341 V) का अपचयन विभव जल (-0.83 V) से अधिक होता है, इसलिए Cu2+ वरीयता के आधार पर अपचयित होंगे तथा कैथोड पर कॉपर धातु जमा होगी।
Cu2+ (aq) + 2e– → Cu (s)
ऐनोड पर : निम्न अभिक्रियाओं के होने की सम्भावना है –
H2O (l) → 1/2 O2 (g) + 2H+ (aq) + 2e– ;
E° = +1.23 V
2Cl– (aq) → Cl2 (g) + 2e– ; E° = + 1.36V
चूँकि जल का अपचयन विभव Cl– (जलीय) आयनों से कम होता है, इसलिए जल वरीयता के आधार पर ऐनोड पर ऑक्सीकृत होगा तथा O2, गैस मुक्त होगी।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
चार क्षार धातुओं A, B, C व D के मानक अपचयन विभव क्रमशः-3.05 -1.66,- 0.40 तथा 0.80 वोल्ट हैं। इनमें से प्रबलतम अपचायक है – (2011)
(i) A
(ii) B
(iii) C
(iv) D
उत्तर
(i) A
प्रश्न 2.
प्रबलतम अपचायक है – (2016)
(i) Li
(ii) Na
(iii) K
(iv) Cs
उत्तर
(i) Li
प्रश्न 3.
25°C पर Li+ /Li, Ba2+ / Ba, Na+ / Na तथा Mg2+/Mg के मानक अपचयन इलेक्ट्रोड विभव क्रमशः -305,- 273 – 271 तथा -237 वोल्ट हैं। सबसे प्रबल ऑक्सीकारक है – (2009, 13, 18)
(i) Ba2+
(ii) Mg2+
(iii) Na+
(iv) Li+
उत्तर
(ii) Mg2+
प्रश्न 4.
किसी भी इलेक्ट्रोड का इलेक्ट्रोड विभव निर्भर करता है – (2012)
(i) धातु की प्रकृति पर
(ii) विलयन के ताप पर
(iii) विलयन की मोलरता पर
(iv) इनमें से सभी पर
उत्तर
(iv) इनमें से सभी पर
प्रश्न 5.
तत्त्वों A, B,C तथा D के मानक अपचयन विभव क्रमशः -2.90, +1.50, -0.74 तथा +0.34 वोल्ट हैं। इनमें सर्वाधिक विभव ऑक्सीकारक है – (2016)
(i) A
(ii) B
(iii) C
(iv) D
उत्तर
(ii) B
प्रश्न 6.
धातु जो सरलता से ऑक्सीकृत हो जाती है – (2017)
(i) Cu
(ii) Ag
(iii) Al
(iv) At
उत्तर
(iii) Al
प्रश्न 7.
चार धातुओं A, B, C तथा D के मानक ऑक्सीकरण इलेक्ट्रोड विभव क्रमशः + 1.5 वोल्ट,- 20 वोल्ट, + 0.84 वोल्ट तथा- 0.36 वोल्ट हैं। इन धातुओं की बढ़ती सक्रियता का क्रम है – (2017)
(i) A < B < C < D
(ii) D < C < B < A
(iii) A < C < D < B
(iv) B < C < D < A
उत्तर
(iii) A < C < D < B
प्रश्न 8.
निम्न में कौन-सा ऑक्साइड हाइड्रोजन द्वारा अपचयित होगा? (2017)
(i) Na2O
(ii) MgO
(iii) Al2O3
(iv) Ag2O
उत्तर
(iv) Ag2O
प्रश्न 9.
Mg, Cu, Na तथा Au की सक्रियता का सही क्रम है – (2016)
(i) Au > Cu > Mg > Na
(ii) Mg > Cu > Au > Na
(iii) Na > Mg > Cu> Au
(iv) Cu > Mg > Na > Au
उत्तर
(iii) Na > Mg > Cu> Au
प्रश्न 10.
चार धातुओं A, B, C, D के मानक इलेक्ट्रोड विभव (E0) क्रमशः + 1.5 V, -20 V, + 0.34 V तथा – 0.76 v हैं। इन धातुओं की घटती हुई सक्रियता का क्रम है –(2014)
(i) A> C> D> B
(ii) A> B> D> C
(iii) B> D> C> A
(iv) D> A> B> C
उत्तर
(iii) B> D> C> A
प्रश्न 11.
A, B और C तत्त्वों का मानक अपचयन विभव क्रमशः +0.68 V,-0.50 V और-2.5 V है। उनकी अपचयन शक्ति का क्रम है – (2017)
(i) A > B > C
(ii) A > C > B
(iii) C > B > A
(iv) B > C > A
उत्तर
(ii) A > C > B
प्रश्न 12.
धातु जो हाइड्रोक्लोरिक अम्ल से H, विस्थापित नहीं कर सकती है, वह है – (2017)
(i) Zn
(ii) Cu
(iii) Mg
(iv) Al
उत्तर
(ii) Cu
प्रश्न 13.
निम्न में से कौन-सी अभिक्रिया सम्भव नहीं है? (2017)
(i) Cu + 2AgNO3 → Cu (NO3)2 + 2Ag
(ii) CaO + H2 → Ca + H2O
(iii) CuO+ H2 → Cu + H2O
(iv) Fe + H2SO4 → FeSO4 + H2 ↑
उत्तर
(i) Cu + 2AgNO3 → Cu (NO3)2 + 2Ag
प्रश्न 14.
आर्यन जिसकी विद्युत चालकता जलीय विलयन में सबसे अधिक है, है – (2014)
(i) Li+
(ii) Na+
(iii) K+
(iv) Cs+
उत्तर
(iv) Cs+
प्रश्न 15.
अच्छे चालकत्व विलयन वाले पदार्थ हैं – (2017)
(i) दुर्बल वैद्युत अपघट्य
(ii) प्रबल वैद्युत अपघट्य
(iii) विद्युत अपघट्य
(iv) उत्प्रेरक
उत्तर
(ii) प्रबल वैद्युत अपघट्य
प्रश्न 16.
KCl विलयन की 25°C पर विशिष्ट चालकता 0.002765 म्हो सेमी-1 है। यदि विलयन सहित सेल का प्रतिरोध 400 ओम हो तो सेल स्थिरांक होगा – (2017)
(i) 0.553 सेमी-1
(ii) 1.106 सेमी-1
(iii) 2.212 सेमी-1
(iv) इनमें से कोई नही
उत्तर
(ii) 1.106 सेमी-1
प्रश्न 17.
जल के विद्युत अपघटन में बनी ऑक्सीजन और हाइड्रोजन का भारात्मक अनुपात है – (2016)
(i) 2 : 1
(ii) 8 : 1
(iii) 16 : 1
(iv) 1 : 4
उत्तर
(i) 2 : 1
प्रश्न 18.
हाइड्रोजन-ऑक्सीजन ईंधने सेल में नेट अभिक्रिया संपन्न होती है – (2016)
(i) 2H2 (g) +4 OH– (aq) → 4H2O (l) +4e–
(ii) O2(g) + 2H2O (l) → 2e –+ 4OH– (aq)
(iii) 2H2(g) + O2 (g) → 2H2O (l)
(iv) इनमें से कोई नहीं
उत्तर
(iii) 2H2(g) + O2 (g) → 2H2O (l)
प्रश्न19.
सीसा संचायक सेल को आवेशित करने पर – (2017)
(i) PbO2 घुलता है।
(ii) लेड इलेक्ट्रोड पर PbSO4 जमता है।
(iii) H2SO4 पुन: बनता है।
(iv) अम्ल की मात्रा घटती है।
उत्तर
(ii) लेड इलेक्ट्रोड पर PbSO4 जमता है।
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
रेडॉक्स विभव किसे कहते हैं? (2014)
उत्तर
जब सेल में ऑक्सीकरण तथा अपचयन अभिक्रिया होती है तो धातु और विलयन के मध्य स्थापित विभवान्तर को रेडॉक्स विभव कहते हैं; जैसे

यदि इस प्रकार के सेल का विभव E हो तो ऑक्सीकारक की सान्द्रता [Ox] तथा अपचायक की सान्द्रता [Red] में 25°C पर निम्नलिखित सम्बन्ध होता है –

जहाँ, E° रेडॉक्स विभव है और n ऑक्सीकारक (Ox) द्वारा ग्रहण किये गये इलेक्ट्रॉनों की संख्या है। जिन्हें ऑक्सीकारक ग्रहण करके अपने संगत अपचायक में बदल देता है।
प्रश्न 2.
किसी सेल के विद्युत वाहक बल से क्या तात्पर्य है? (2017)
उत्तर
किसी सेल के इलेक्ट्रोडों के इलेक्ट्रोड विभवों में वह अन्तर, जब सेल से परिपथ में कोई विद्युत धारा नहीं बहती है, सेल को विद्युत वाहक बल कहलाता है।
प्रश्न 3.
निम्नलिखित सम्भव अभिक्रियाओं की सहायता से Mg, Zn, Cu और Ag को उनके घटते हुए इलेक्ट्रोड विभव के क्रम में लिखिए – (2014)
- Cu + 2Ag+ → Cu2+ + 2Ag
- Mg + Zn2+ → Mg2+ + Zn
- Zn + Cu2+ → Zn2+ + Cu
उत्तर
- Cu + 2Ag+ → Cu2+ + 2Ag
E°Cu > E°Ag - Mg + Zn2+ → Mg2+ + Zn
E°Mg > E°Zn - Zn + Cu2+ → Zn2+ + Cu
E°Zn > E°Cu
अतः E° का घटता हुआ क्रम इस प्रकार होगा –

प्रश्न 4.
Mg, Zn, Cu, Ag में से किस तत्त्व की अम्ल से अभिक्रिया होने पर हाइड्रोजन गैस विमुक्त होती है? (2015)
उत्तर
Mg तथा Zn अम्ल से अभिक्रिया करके H, गैस विमुक्त करते हैं क्योंकि विद्युत रासायनिक श्रेणी में Mg तथा Zn का स्थान हाइड्रोजन से ऊपर है अर्थात् Mg तथा Zn की अपचायक क्षमता हाइड्रोजन से अधिक है।
प्रश्न 5.
कॉपर सल्फेट के विलयन में लोहे की कील डालने पर क्या होगा? (2016)
उत्तर
कॉपर सल्फेट के विलयन में लोहे की कील डालने पर लोहे की कील के ऊपर कॉपर की परत चढ़ जायेगी, क्योंकि कॉपर की सक्रियता लोहे से कम होती है।
प्रश्न 6.
जिंक तथा ताँबे में से एक अम्लों से हाइड्रोजन गैस विस्थापित नहीं करता है। क्यों? (2016)
उत्तर
वैद्युत रासायनिक श्रेणी में जिंक हाइड्रोजन से ऊपर तथा ताँबा हाइड्रोजन से नीचे स्थित है जिसके कारण जिंक हाइड्रोजन से अधिक अपचायक है और ताँबा कम अपचायक है। इसीलिए जिंक अम्लों से हाइड्रोजन को विस्थाप्रित करता है परन्तु, ताँबा नहीं करता है।
प्रश्न 7.
यद्यपि विद्युत रासायनिक श्रेणी में ऐलुमिनियम हाइड्रोजन से ऊपर है किन्तु यह वायु और जल में स्थायी है। क्यों? (2016, 18)
उत्तर
यद्यपि विद्युत रासायनिक श्रेणी में ऐलुमिनियम हाइड्रोजन से ऊपर है किन्तु यह वायु और जल में स्थायी है क्योंकि यह गर्म जल या जलवायु के साथ उच्च ताप पर क्रिया करता है और साधारण ताप पर जल के साथ इसकी क्रिया मन्द होती है।
प्रश्न 8.
Zn तथा Fe, कॉपर सल्फेट (CuSO4) में Cu को विस्थापित कर सकते हैं, परन्तु Pt और Ag नहीं करते। कारण स्पष्ट कीजिए। (2009, 12, 13)
या
Zn, CuSO4 विलयन से कॉपर को विस्थापित कर सकता है जबकि सोना (Ag) ऐसा नहीं कर सकता है। क्यों? (2017)
उत्तर
कम इलेक्ट्रोड विभव वाली धातु अधिक इलेक्ट्रोड विभव वाली धातु को उसके लवण के विलयन में से प्रतिस्थापित कर देती है। विद्युत रासायनिक श्रेणी में नीचे की ओर चलने पर इलेक्ट्रोड विभव कम होता जाता है। चूंकि विद्युत रासायनिक श्रेणी में Zn तथा Fe धातुएँ Cu से नीचे स्थित हैं अत: इनका इलेक्ट्रोड विभव Cu से कम होता है और ये Cu को उसके लवण विलयन CuSO4 में से विस्थापित कर देती हैं, जबकि Pt और Ag का स्थान विद्युत रासायनिक श्रेणी में Cu से ऊपर होता है जिसके कारण इनका इलेक्ट्रोड विभव Cu से अधिक होता है। इसी कारण से ये Cu को इसके लवण विलयन में से विस्थापित नहीं कर पाती हैं।
प्रश्न 9.
सिल्वर नाइट्रेट के घोल में कॉपर की छड़ डालने पर घोल नीला क्यों हो जाता है? (2010, 16)
उत्तर
वैद्युत रासायनिक श्रेणी का प्रत्येक तत्त्व अपने से नीचे स्थित तत्त्वों को उसके विलयन से विस्थापित कर सकता है। श्रेणी में Cu का स्थान Ag से ऊपर है. अत: यह AgNO3 से निम्नलिखित क्रिया देगा –
Cu + 2AgNO3 → Cu2+ + 2NO–3 + 2Ag
इस प्रकार विलयन में क्यूप्रिंक आयन (Cu2+) विद्यमान होने से विलयन का रंग नीला हो जायेगा।
प्रश्न 10.
विशिष्ट चालकता से क्या तात्पर्य है? इसका मात्रक क्या है? (2014, 17)
उत्तर
किसी चालक के विशिष्ट प्रतिरोध के व्युत्क्रम को उस चालक की विशिष्ट चालकता (या केवल चालकता) कहते हैं। इसे ग्रीक अक्षर K (कप्पा, kappa) से निरूपित किया जाता है।
k =
विशिष्ट चालकता के मात्रक ओम-1 सेमी-1 या Ω-1 सेमी-1 या S सेमी-1 हैं।
प्रश्न11.
एक विद्युत अपघट्य विलयन की मोलर चालकता को परिभाषित कीजिए तथा उसके मात्रक लिखिए। (2014, 18)
उत्तर
किसी विलयन के एक निश्चित आयतन में उपस्थित एक विद्युत अपघट्य पदार्थ के एक मोल द्वारा उपलब्ध कराये गये आयनों की चालकता को मोलर चालकता कहते हैं। इसे A से प्रदर्शित करते हैं। मोलर चालकता के मात्रक ओम-1 सेमी2 मोल-1 या S सेमी2 मोल-1 हैं।
प्रश्न 12.
कोलराउश का नियम क्या है? (2014, 15, 16, 17)
उत्तर
इस नियम के अनुसार, “किसी विद्युत अपघट्य की अनन्त तनुता पर चालकता इसके धनायनों तथा ऋणायनों की मोलर चालकताओं के योग के बराबर होती है, यदि प्रत्येक चालकता पद को विद्युत अपघट्य सूत्र में उपस्थित संगत आयनों की संख्या से गुणा किया जाये।”
![]()
प्रश्न13.
मोलर चालकता तथा तुल्यांक चालकता में क्या सम्बन्ध है? (2017)
उत्तर
मोलर चालकता तथा तुल्यांक चालकता में निम्नलिखित सम्बन्ध है –

प्रश्न14.
विद्युत अपघटन की क्रियाविधि उपयुक्त उदाहरण सहित समझाइए। (2016)
उत्तर
किसी विद्युत अपघट्य का विद्युत धारा द्वारा अपघटन विद्युत अपघटन कहलाता है। उदाहरणार्थ- गलित सोडियम क्लोराइड में विद्युत धारा प्रवाहित करने पर यह सोडियम और क्लोरीन में अपघटित हो जाता है।

प्रश्न15.
फैराडे का विद्युत अपघटन का प्रथम नियम लिखिए। (2017)
उत्तर
इस नियम के अनुसार, “विद्युत अपघटन की प्रक्रिया में किसी इलेक्ट्रोड विशेष पर मुक्त (अथवा एकत्रित) पदार्थ का द्रव्यमान विलयन में प्रवाहित की गई विद्युत की मात्रा (कुल आवेश) के समानुपाती होता है।”
प्रश्न16.
फैराडे का विद्युत अपघटन का द्वितीय नियम लिखिए। (2016, 17)
उत्तर
इस नियम के अनुसार, “जब श्रेणीक्रम में जुड़े विभिन्न विद्युत अपघट्यों के विलयनों में समान मात्रा में विद्युत प्रवाहित की जाती है, तो इलेक्ट्रोडों पर मुक्त (या एकत्रित) पदार्थों के द्रव्यमान उनके तुल्यांक भारों के समानुपाती होते हैं।’
अर्थात् W1 ∝ E1 W2 ∝ E2, =
=
प्रश्न17.
विद्युत लेपन को उदाहरण द्वारा संक्षेप में समझाइए। (2014)
उत्तर
विद्युत अपघटन द्वारा कम सक्रिय धातु की कलई अधिक सक्रिय धातु पर चढ़ाई जाती है। इस प्रक्रिया को विद्युत लेपन कहते हैं। धातुओं की होने वाली अवांछनीय संक्षारण क्रिया को विद्युत लेपन द्वारा रोका जाता है।
उदाहरणार्थ– लोहे की चादर पर जिंक या टिन का लेप किया जाता है। क्योंकि जिंक या टिन की सक्रियता लोहे से कम है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
विद्युत अपघटनी सेल तथा गैल्वेनी सेल में अन्तर स्पष्ट कीजिए। (2014, 15, 17)
उत्तर
विद्युत अपघटनी सेल तथा गैल्वेनी सेल में निम्न अन्तर हैं –

प्रश्न 2.
इलेक्ट्रोड विभव किसे कहते हैं? इसका मान किन-किन कारकों पर निर्भर करता है? (2012, 15)
उत्तर
जब किसी धातु (इलेक्ट्रोड) को उसी धातु के किसी लवण विलयन में रखा जाता है तो धातु तथा विलयन के सम्पर्क स्थल पर वैद्युत द्विक-स्तर (electrical double layer) उत्पन्न हो जाता है जिसके फलस्वरूप धातु तथा विलयन के मध्य विभवान्तर उत्पन्न हो जाता है जिसे इलेक्ट्रोड विभव (electrode potential) कहते हैं। इसे E° से प्रकट करते हैं और इसे वोल्ट में मापा जाता है। उदाहरणार्थ-जब कॉपर की छड़, कॉपर सल्फेट के विलयन में डुबोई जाती है तो कॉपर की छड़, विलयन के सापेक्ष ऋणावेशित हो जाती है जिससे कॉपर धातु और कॉपर आयनों के मध्य विभवान्तर उत्पन्न हो जाता है।
Cu (s) Cu2+ + 2e–
इस विभवान्तर को कॉपर इलेक्ट्रोड का विभव कहते हैं।
इलेक्ट्रोड विभव निम्नलिखित कारकों पर निर्भर करता है –
- चालक की प्रकृति – जिस इलेक्ट्रोड की चालकता अधिक होगी वह उतना ही अधिक इलेक्ट्रोड विभवे उत्पन्न करता है।
- धात्विक आयन की विलयन में सान्द्रता – सान्द्रता बढ़ाने पर इलेक्ट्रोड विभव को मान घटता है, क्योंकि सान्द्रता बढ़ाने पर आयनन घट जाता है, फलस्वरूप चालकता कम हो जाती है।
- तापक्रम – इलेक्ट्रोड विभव का मान ताप पर भी निर्भर करता है जो ताप बढ़ाने पर आयनन बढ़ जाने के कारण बढ़ता है।
प्रश्न 3.
मानक इलेक्ट्रोड विभव क्या है? इलेक्ट्रोड विभव (E) और मानक इलेक्ट्रोड विभव (E°) में सम्बन्ध लिखिए। (2016)
या
टिप्पणी लिखिए-नेर्नस्ट समीकरण। (2015, 16, 17)
उत्तर
मानकं इलेक्ट्रोड विभव – किसी धातु की छड़ को 25°C पर एक मोलर धातु आयन सान्द्रता के विलयन में डुबोने पर धातु और विलयन के मध्य जो विभवान्तर उत्पन्न होता है उसे धातु का मानक इलेक्ट्रोड विभव (E°) कहते हैं।
इलेक्ट्रोड विभव (E) और मानक इलेक्ट्रोड विभव (E°) में सम्बन्ध
माना एक इलेक्ट्रोड अभिक्रिया इस प्रकार है –

नेर्नस्ट के अनुसार, किसी ताप T पर धातु इलेक्ट्रोड M| Mn+ के विभव E और विलयन में धातु आयनों की सान्द्रता [Mn+] में निम्नलिखित सम्बन्ध होता है,

इसे नेर्नस्ट समीकरण भी कहते हैं।
जहाँ E° धातु का मानक इलेक्ट्रोड विभव (वोल्ट में), R गैस नियतांक (R= 8.312 JK-1 mol-1), T परम ताप (केल्विन में), F फैराडे नियतांक (F = 96,485 C mol-1), n इलेक्ट्रोड अभिक्रिया में भाग लेने वाले इलेक्ट्रॉनों के मोलों की संख्या तथा [Mn+] विलयन में धातु आयनों की सक्रियता (activity) अथवा मोल प्रति लीटर में व्यक्त सान्द्रता है।
प्रश्न 4.
निम्नलिखित सेल के विद्युत वाहक बल की गणना कीजिए – (2017)
Cu | Cu++ (1M) | Ag+ (1M) | Ag
दिया है : E° Cu2+ | Cu= + 0.34 volt
E° Ag+ | Ag = + 0.80 volt
हल

प्रश्न 5.
निम्नलिखित सेल का e.m.f. निकालिए। यह भी बताइए कि कौन-सा इलेक्ट्रोड धन ध्रुव और कौन-सा ऋण ध्रुव है? सेल में होने वाली अर्द्ध अभिक्रियाएँ और पूर्ण अभिक्रियाएँ लिखिए – (2015)
Ni | Ni++ (0.1M) || Ag+ (0.1M) | Ag
E° Ni++ | Ni=- 0.25 v और E° Ag+ | Ag= + 0.80 V
हल

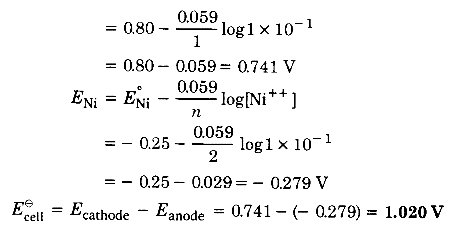
प्रश्न 6.
वैद्युत रासायनिक श्रेणी किसे कहते हैं? इसके प्रमुख लक्षण तथा दो प्रमुख उपयोग लिखिए। (2009, 10, 12, 14, 16, 17)
उत्तर
वैद्युत रासायनिक श्रेणी–विभिन्न धातुओं तथा अधातुओं के मानक इलेक्ट्रोड विभवों (अपचयन विभव) को बढ़ते हुए क्रम में रखने पर जो श्रेणी प्राप्त होती है, उसे वैद्युत रासायनिक श्रेणी कहते हैं।
वैद्युत रासायनिक श्रेणी के लक्षण
- श्रेणी में ऊपर से नीचे की ओर जाने पर तत्त्वों की अपचयन क्षमता घटती है, जबकि नीचे से ऊपर जाने पर अपचयन क्षमता बढ़ती है।
- हाइड्रोजन से ऊपर के सभी तत्त्व अम्लों से अभिक्रिया करके हाइड्रोजन गैस मुक्त करते हैं, जबकि नीचे वाले तत्त्व अम्लों से अभिक्रिया करके हाइड्रोजन गैस मुक्त नहीं करते।
- हाइड्रोजन से ऊपर के सभी तत्त्व जल या भाप के साथ क्रिया करके H, गैस देते हैं।
- जिस तत्त्व का अपचयन विभव जितना अधिक होता है, वह उतना ही प्रबल ऑक्सीकारक होता है।
- जिस तत्त्व का अपचयन विभव जितना कम होता है, वह उतना ही प्रबल अपचायक होता है।
- श्रेणी का ऊपर वाला तत्त्व नीचे वाले तत्त्व को उसके विलयन से विस्थापित कर देता है।
उपयोग – वैद्युत रासायनिक श्रेणी के दो उपयोग निम्नवत् हैं –
- किसी सेल के मानक वैद्युत वाहक बल का निर्धारण करने में,
- धातुओं की क्रियाशीलता की तुलना करने में।
प्रश्न 7.
गरम करने पर HgO अपघटित हो जाता है परन्तु MgO नहीं। क्यों? (2017)
उत्तर
जो धातु विद्युत रासायनिक श्रेणी में Cu से नीचे हैं उनके ऑक्साइड कम स्थायी होते हैं और वे गर्म करने पर आसानी से अपघटित हो जाते हैं।
2HgO 2Hg + O2
MgO कोई विघटन नहीं
प्रश्न 8.
निम्नलिखित को कारण सहित समझाइए –
- क्लोरीन KI विलयन से I2 को विस्थापित कर देती है परन्तु I2, KBr विलयन से ब्रोमीन को विस्थापित नहीं करती है। क्यों ? (2017)
- Hg+ H2SO4 → HgSO4 + H2
उपर्युक्त अभिक्रिया सम्भव नहीं है। (2017)
उत्तर
1. Cl2 की ऑक्सीकारक क्षमता आयोडीन से अधिक है इसलिए Cl2 KI विलयन से आयोडीन को विस्थापित कर देती है।
2KI + Cl2 → 2KCl + I2
I2 की ऑक्सीकारक क्षमता ब्रोमीन से कम है इसलिए I2, KBr विलयन से ब्रोमीन को विस्थापित नहीं कर पाती है।
2KBr + I2 → कोई अभिक्रिया नहीं
2. Hg विद्युत रासायनिक श्रेणी में हाइड्रोजन से नीचे है इसलिए Hg, H2SO4 से हाइड्रोजन को विस्थापित नहीं कर पाती है।
Hg+ H2SO4 → कोई अभिक्रिया नहीं
प्रश्न 9.
कोलराउश के नियम की सहायता से आप ऐसीटिक अम्ल की अनन्त तनुता पर मोलर चालकता किस प्रकार ज्ञात करेंगे? (2014, 15)
उत्तर
कोलराउश के नियम की सहायता से किसी दुर्बल विद्युत अपघट्य की अनन्त तनुता पर मोलर चालकता का निर्धारण आसानी से किया जा सकता है। जैसे- CH3COOH के लिए Δ∞m का मान निम्न प्रकार से प्राप्त किया जा सकता है –
कोलराउश के नियम के अनुसार,
![]()
यदि H+ आयन तथा CH3COO– आयन के लिए अनन्त तनुता पर मोलर चालकताओं के मान ज्ञात हैं। तो उपर्युक्त समीकरण की सहायता से CH3COOH के लिए Δ∞m का मान आसानी से ज्ञात किया जा सकता है। यदि आयनिक चालकताएँ ज्ञात नहीं हैं तो निम्न परोक्ष विधि का प्रयोग किया जाता हैपरोक्ष विधि में तीन (या अधिक) ऐसे प्रबल विद्युत अपघट्यों का चुनाव किया जाता है जिनके Δ∞m के मानों के योग/अन्तर से विचाराधीन दुर्बल विद्युत अपघट्य के Δ∞m का मान प्राप्त किया जा सके जैसे- CH3COOH के Δm के मान को निर्धारित करने के लिए HCl, CH3COONa तथा NaCl का चुनाव किया जाता है और इनके Δ∞m के मानों को बहिर्वेशन विधि द्वारा ज्ञात कर लिया जाता है। कोलराउश के नियम के अनुसार,
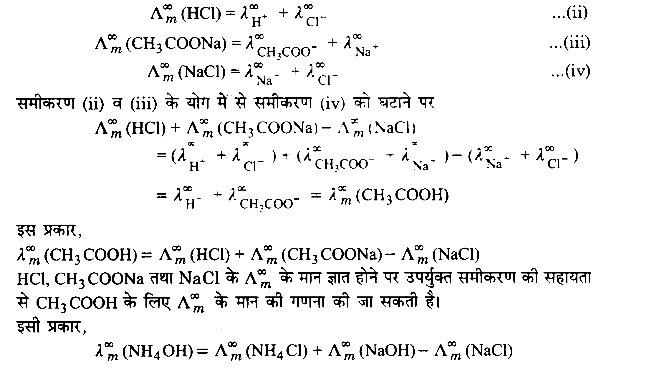
प्रश्न 10.
क्या कारण है कि गलित कैल्शियम हाइड्राइड का विद्युत अपघटन करने पर हाइड्रोजन ऐनोड पर मुक्त होती है? समझाइए। (2017)
उत्तर
गलित CaH2 में हाइड्रोजन हाइड्राइड आयन H के रूप में रहता है और विद्युत अपघटन करने पर H को ऑक्सीकरण होता है।
CaH2 → Ca2+ + 2H–
2H– → H2 +2e– (ऐनोड)
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
निम्न सेलों की संरचना तथा कार्य प्रणाली का वर्णन कीजिए
- शुष्क सेल तथा
- मर्करी सेल। (2014)
उत्तर
1. शुष्क सेल – यह सबसे अधिक प्रयोग किए जाने वाला प्राथमिक व्यापारिक सेल है। एक सामान्य शुष्क सेल को संलग्न चित्र में दर्शाया गया है। इसमें जिंक धातु से बना एक पात्र होता है जो ऐनोड का कार्य करता है। MnO2 + C चूर्ण से घिरी एक ग्रेफाइट छड़ कैथोड का कार्य करती है। जिंक पात्र तथा ग्रेफाइट छड़ के मध्य के रिक्त स्थान में NH4Cl तथा ZnCl2 का एक नम पेस्ट भरा रहता है। जिंक पात्र के चारों ओर गत्ते का आवरण चढ़ा रहता है। सेल के ऊपरी सिरे को मोम अथवा पिच (pitch) से सील कर दिया जाता है।
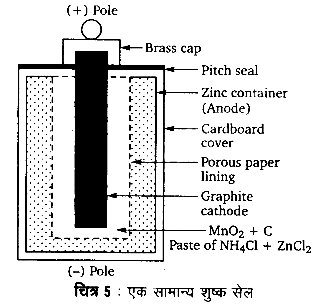
इस सेल में जटिल रासायनिक अभिक्रियाएँ होती हैं।
इन अभिक्रियाओं को सरल रूप में निम्न प्रकार से व्यक्त किया जा सकता है-
ऐनोड पर– Zn(s) → Zn2+ + 2e–
कैथोड पर– MnO2 + NH+4 +e– → MnO(OH) + NH3
ऐनोड पर जिंक ऑक्सीकृत होकर Zn2+ आयनों में परिवर्तित होता है। कैथोड पर मैंगनीज +4 अवस्था से +3 ऑक्सीकरण अवस्था में अपचयित होता है। कैथोड अभिक्रिया में उत्पन्न अमोनिया ऐनोडिक अभिक्रिया में उत्पन्न Zn2+ आयनों से संयोग कर Zn(NH3)+4 आयनों का निर्माण करती है। Zn2+ आयनों के NH3 अणुओं द्वारा जटिलीकरण के कारण मुक्त Zn2+ आयनों की सान्द्रता घट जाती है। जिससे सेल की वोल्टता (voltage) में वृद्धि होती है।
शुष्क सेल का विभव लगभग 1.25 – 1.5 V होता है। इन सेलों की आयु अधिक नहीं होती है क्योंकि सेल में प्रयुक्त NH4Cl अम्लीय प्रकृति का होता है और प्रयोग में न लेने की अवस्था में भी जिंक पात्र का संक्षारण (corrosion) करता रहता है। यह एक प्राथमिक सेल है तथा इसे पुनः आवेशित करना सम्भव नहीं है।
(ii) मर्करी सेल – मर्करी सेल एक विशेष प्रकार का शुष्क सेल है जिसका उपयोग प्राय: घड़ी, कैमरा आदि छोटे यन्त्रों में ऊर्जा स्रोत के रूप में किया जाता है।
मर्करी सेल में जिंक-मर्करी अमलगम ऐनोड के रूप में कार्य करता है। मरक्यूरिक ऑक्साइड (HgO) तथा कार्बन का एक पेस्ट कैथोड का कार्य करता है। पोटैशियम हाइड्रॉक्साइड (KOH) तथा जिंक ऑक्साइड (ZnO) के एक पेस्ट को विद्युत अपघट्य के रूप में प्रयोग में लाया जाता है। सेल में निम्न अभिक्रियाएँ होती हैं –
ऐनोड पर – Zn (amalgam) + 2OH– → ZnO(s) + H20+ 2e–
कैथोड पर – HgO(s) + H2O+ 2e– → Hg(l) + 2OH–
नेट सेल अभिक्रिया –
Zn(amalgam) + HgO(s) → ZnO(s) + Hg(l)
इस सेल की सेल अभिक्रिया में विलयन में उपस्थित कोई ऐसा आयन निहित नहीं है जिसकी सान्द्रता में परिवर्तन हो सकता हो। इस कारण इस सेल का सेल विभव केवल प्रयोग की अवधि में ही नहीं अपितु इसके सम्पूर्ण कार्यकाल में स्थिर रहता है। इसका सेल विभव लगभग 1.35 V है।
प्रश्न 2.
एक लेड संचायक बैटरी की संरचना तथा कार्य प्रणाली का वर्णन कीजिए। इस बैटरी के पुनः आवेशन में निहित अभिक्रियाओं को लिखिए।
या
किसी व्यापारिक सेल का वर्णन कीजिए। (2015)
या
सीसा संचायक सेल का संक्षिप्त वर्णन करते हुए इसके ऐनोड और कैथोड पर होने वाली अभिक्रियाएँ लिखिए। (2018)
उत्तर
लेड संचायक बैटरी – यह सबसे अधिक प्रयोग की जाने वाली संचायक बैटरी है। इसका उपयोग सभी स्वचालित वाहनों, जैसे-कार, बस आदि में तथा घरेलू ऊर्जा स्रोतों (power inverters) में किया जाता है। इसमें अनेक लेड संचायक सेल (lead storage cells) श्रेणीक्रम में व्यवस्थित होते हैं।
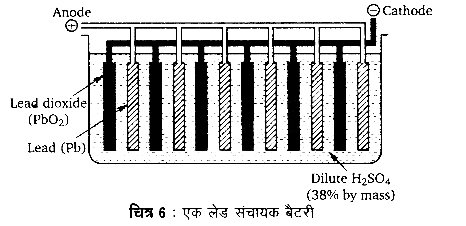
एक लेड संचायक सेल वास्तव में एक गैल्वेनिक सेल है जिसमें ऐनोड सूक्ष्म वितरित स्पंजी लेड (finely divided spongy lead) से पैक की गई लेड (या लेड-ऐन्टीमनी मिश्र धातु) की एक जाली का बना होता है, जबकि कैथोड लेड डाइऑक्साइड (PbO2) की एक परत युक्त एक लेड की जाली का बना होता है। विद्युत अपघट्य के रूप में सल्फ्यूरिक अम्ल के एक तनु विलयन (लगभग 38% द्रव्यमानानुसार) का प्रयोग किया जाता है जिसका विशिष्ट घनत्व (specific gravity) 1.3 g cm होता है। एक संचायक सेल का सेल विभव 2 वोल्ट होता है।
लेड संचायक बैटरी बनाने के लिए अनेक लेड संचायक सेलों को श्रेणीक्रम में जोड़ा जाता है। सेल विभव (emf) 12 V प्राप्त करने के लिए 6 सेलों को तथा सेल विभव 24 V प्राप्त करने के लिए 12 सेलों को श्रेणीक्रम में जोड़ने की आवश्यकता होती है। एक लेड संचायक बैटरी में ऐनोड तथा कैथोड़ प्लेटें (जिन्हें ग्रिड (grids) कहा जाता है। एकान्तर रूप में व्यवस्थित होती हैं तथा सल्फ्यूरिक अम्ल के 38% विलयन में डूबी रहती हैं। ऐनोडों तथा कैथोडों को एक-दूसरे से पृथक् करने के लिए कुचालक पदार्थ से बने पृथक्कारकों (separators) को प्रयोग किया जाता है। ऐलोड तथा कैथोड प्लेटें पृथक् रूप से एक-दूसरे से जोड़ दी जाती हैं। इससे इलेक्ट्रोडों के पृष्ठ क्षेत्रफल में वृद्धि होती है तथा बैटरी की विद्युत उत्पादन क्षमता में वृद्धि हो जाती है।
बैटरी में स्थित प्रत्येक सेल में निम्न इलेक्ट्रोड अभिक्रियाएँ होती हैं –
ऐनोड पर : Pb(s) + SO2-4(aq) → PbSO4 (5) + 2e–
कैथोड पर : PbO2 (s) + SO2-4 (aq) + 4H+ (aq) + 2e– → PbSO4 (s) + 2H2O
शुद्ध सेल अभिक्रिया :
Pb (s) + PbO2 (s) + 4H+ (aq) + 2SO2-4 (aq) → 2PbSO4 (s) + 2H2O
उपर्युक्त अभिक्रियाओं से स्पष्ट है कि सेल (बैटरी) से विद्युत-धारा ग्रहण करने की प्रक्रिया (discharging of the cell) में सल्फ्यूरिक अम्ल का उपभोग होता है और इस कारण सेल में उपस्थित सल्फ्यूरिक अम्ल तनु हो जाता है एवं इसका विशिष्ट घनत्व कम हो जाता है। दोनों प्रकार के इलेक्ट्रोडों पर PbSO4 का सफेद अवक्षेप जमा हो जाता है। जब सल्फ्यूरिक अम्ल का विशिष्ट घनत्व
1.2 g cm-3 से कम हो जाता है तथा दोनों प्रकार के इलेक्ट्रोड PbSO4 से आच्छादित हो जाते हैं तो सेल अभिक्रिया रुक जाती है। ऐसे सेल (बैटरी) को निरावेशित (discharged) कहा जाता है। इस स्थिति में सेल (बैटरी) को पुनः आवेशित करने की आवश्यकता होती है।
पुनः आवेशन—निरावेशित लेड संचायक सेल (बैटरी) को विपरीत दिशा में किसी बाह्य स्रोत से दिष्ट धारा (D.C.) प्रवाहित कर पुनः आवेशित किया जा सकता है। इसके लिए संचायक सेल (बैटरी) के ऋणात्मक इलेक्ट्रोड टर्मिनल को एक दिष्ट धारा स्रोत के ऋणात्मक से तथा सेल (बैटरी) के धनात्मक इलेक्ट्रोड को स्रोत के धनात्मक टर्मिनल से जोड़ा जाता है। विद्युत धारा प्रवाहित करने पर इलेक्ट्रोड
अभिक्रियाएँ उत्क्रमित हो जाती हैं जिससे PbSO4 ऋणात्मक इलेक्ट्रोड पर Pb में तथा धनात्मक इलेक्ट्रोड पर PbO2 में परिवर्तित हो जाता है। पुनः आवेशन के समय निम्न अभिक्रियाएँ होती हैं –
ऐनोड पर – PbSO4 (5) + 2e– → Pb(s) + SO2-4 (aq)
कैथोड पर – PbSO4 (s) + 2H2O → PbO2(s) + 4H+ (aq) + SO4 (aq) + 2e–
शुद्ध आवेशन अभिक्रिया –
2PbSO4 (s) + 2H2O Pb(s) + PbO2(s) + 4H+ (aq) + 2SO2-4 (aq)
उपर्युक्त अभिक्रियाओं से स्पष्ट है कि सेल (बैटरी) की पुन: आवेशन प्रक्रिया में इलेक्ट्रोड पदार्थ अपने मूल रूप में पुनः प्राप्त हो जाते हैं तथा H+ एवं SO2-4 आयनों के निर्माण के कारण H2SO4 के विशिष्ट घनत्व में वृद्धि होती है और यह बढ़कर पुनः 1.3 g cm-3 हो जाता है। इस प्रकार सेल (बैटरी) पुनः विद्युत धारा को उत्पन्न करने में सक्षम हो जाती है और इसे पुन: उपयोग में लाया जा सकता है।
प्रश्न 3.
संक्षारण क्या है और यह किन कारकों पर निर्भर करता है? इसे एक विद्युत रासायनिक घटना क्यों माना जाता है? (2015)
या
लोहे पर जंग लगने से क्या तात्पर्य है? किन परिस्थितियों में लोहे पर जंग लगती है? जंग लगने की क्रियाविधि का वर्णन कीजिए।
या
लोहे को जंग लगने से बचाने के लिए प्रयुक्त कुछ प्रमुख विधियों का वर्णन कीजिए।
या
संक्षारण से आप क्या समझते हैं? इसे प्रेरित करने वाले मुख्य कारकों का वर्णन कीजिए।
या
धातुओं के बलिदानी रक्षण का क्या अभिप्राय है और इसे कैसे सम्पन्न किया जाता है?
या
कैथोडिक रक्षण से आप क्या समझते हैं? यह किस प्रकार लोहे को जंग लगने से बचाता है?
उत्तर
संक्षारण – जब एक धातु को किसी विशिष्ट वातावरण में रखा जाता है तो वह वातावरण से क्रिया कर सकती है जिसके फलस्वरूप उसकी सतह कलुषित (deteriorate) हो सकती है। इस घटना को संक्षारण (corrosion) कहते हैं।
अधिकांश धातुएँ वायुमण्डल में रखे जाने पर किसी न किसी रूप में प्रभावित होती हैं। वायुमण्डल में उपस्थित गैसें धातु से मन्द गति से क्रिया कर उसकी सतह को कलुषित कर देती हैं। इससे धातुएँ अपनी विशिष्ट चमक खो देती हैं। कुछ धातुओं की शक्ति कम हो जाती है और वे दुर्बल तथा भंगुर (brittle) । हो जाती हैं। चाँदी की चमक का कम होना (tarnishing of silver), लोहे पर जंग लगना (rusting on iron), ताँबे या कॉसे पर हरी परत का जमा होना आदि संक्षारण के कुछ सामान्य उदाहरण हैं। संक्षारण को निम्न प्रकार से परिभाषित किया जा सकता है –
किसी निश्चित वातावरण की मन्द किन्तु स्वतः प्रवर्तित क्रिया द्वारा धातुओं की सतह के कलुषित (deteriorate) होने की प्रक्रिया को संक्षारण कहा जाता है।
संक्षारण को प्रभावित करने वाले कारक
धातुओं का संक्षारण अनेक कारकों पर निर्भर करता है। इनमें से कुछ प्रमुख कारक निम्न हैं –
1. धातु की क्रियाशीलता – अधिक क्रियाशील धातु के संक्षारण की सम्भावना किसी अन्य कम क्रियाशील धातु की तुलना में अधिक होती है। उदाहरणार्थ- लोहा अपने से कम क्रियाशील धातु चाँदी की तुलना में अधिक तेजी से संक्षारित होता है। किसी धातु की क्रियाशीलता उसकी विद्युत धनात्मक प्रकृति पर निर्भर करती है। धातु की विद्युत धनात्मक प्रकृति जितनी अधिक होगी, वह उतनी ही अधिक क्रियाशील होगी। इस प्रकार धातुएँ जैसे-Na, Ca, Mg, Al, Zn आदि शीघ्रता से संक्षारित होती हैं।
2. धातु में अशुद्धियों की उपस्थिति – शुद्ध धातुएँ प्राय: अधिक संक्षारित नहीं होती हैं। एक धातु में अन्य अशुद्ध धातुओं की उपस्थिति उस धातु में संक्षारण को प्रेरित करती है। इसका कारण यह है कि कम विद्युत धनात्मक अशुद्ध धातुएँ ग्राही धातु के साथ गैल्वेनिक सेलों का निर्माण करती हैं जिससे ग्राही धातु संक्षारित हो जाती है।
3. जल में विद्युत अपघट्यों की उपस्थिति – जल में विद्युत अपघट्य पदार्थों की उपस्थिति संक्षारण की दर में वृद्धि करती है। उदाहरणार्थ-लोहे का संक्षारण आसुत जल की तुलना में समुद्री जल में अधिक सीमा तक होता है, क्योंकि समुद्री जल में अनेक विद्युत अपघट्य जैसे NaCl, KCl आदि घुले रहते हैं।
4. वायु में क्रियाशील गैसों की उपस्थिति – वायु में उपस्थित क्रियाशील गैसें; जैसे- CO2 , SO2, NO2 आदि जल में घुलकर अम्लों का निर्माण करती हैं, जो विद्युत-अपघट्यों का कार्य करते हैं एवं संक्षारण प्रक्रिया को त्वरित करते हैं।
लोहे पर जंग लगना – जब लोहे के एक टुकड़े को नम वायु में खुला रखा जाता है, तो उसकी सतह पर एक लाल-भूरी (reddish brown) परत बन जाती है। इस परत को आसानी से खुरचा जा सकता है। नम वायु की क्रिया द्वारा लोहे की सतह पर एक लाल-भूरी परत के जमा होने की प्रक्रिया को जंग लगना कहते हैं तथा लाल-भूरी परत को जंग कहा जाता है।
लोहे पर जंग लगना वास्तव में वायु, जल तथा कार्बन डाइऑक्साइड की लोहे से संयुक्त अभिक्रिया के कारण होता है। पूर्णरूप से शुष्क वायु या वायु मुक्त शुद्ध जल में लोहे पर जंग नहीं लगती है। जंग की सही संरचना वायुमण्डलीय परिस्थितियों तथा जंग को प्रेरित करने वाले कारकों के सापेक्ष योगदान पर निर्भर करती है। यह मुख्य रूप से जलयोजित फैरिक ऑक्साइड Fe2O3.xH2O है। इसके निर्माण को सरल रूप में निम्न समीकरण द्वारा प्रदर्शित किया जा सकता है –

जंग लगने की प्रक्रिया में नम वायु की उपस्थिति में सर्वप्रथम लोहे की बाहरी सतह जंग ग्रस्त होती है। और सतह पर जलयोजित फेरिक ऑक्साइड (जंग) की एक परत जमा हो जाती है। यह परत मुलायम तथा सरन्ध्र होती है और मोटाई बढ़ने पर स्वयं नीचे गिर सकती है। परत के नीचे गिरने से लोहे की आन्तरिक परत वायुमण्डल के सम्पर्क में आ जाती है और उस पर भी जंग लग जाती है। इस प्रकार यह प्रक्रम चलता रहता है और धीरे-धीरे लोहा अपनी शक्ति खोता रहता है।
लोहे पर जंग लगने की प्रक्रिया निम्नलिखित कारकों से प्रेरित तथा अधिशासित होती है –
- वायु की उपस्थिति
- नमी की उपस्थिति
- कार्बन डाइऑक्साइड की उपस्थिति
- जल में विद्युत अपघट्यों की उपस्थिति
- लोहे में कम विद्युत धनात्मक धातुओं की अशुद्धि के रूप में उपस्थिति
संक्षारण की क्रियाविधि – संक्षारण की क्रियाविधि की व्याख्या करने के लिए समय-समय पर अनेक सिद्धान्तों का प्रतिपादन किया गया है। इन सिद्धान्तों में विद्युत रासायनिक सिद्धान्त (electrochemical theory) सर्वाधिक मान्य है।
विद्युत रासायनिक सिद्धान्त के अनुसार, संक्षारण मूल रूप से एक विद्युत रासायनिक घटना है। यह मुख्य रूप से धातु सतह के विभिन्न भागों के विद्युत रासायनिक व्यवहारों में भिन्नता के कारण सम्पन्न होती है। लोहे पर जंग लगना संक्षारण का एक विशिष्ट रूप है। विद्युत रासायनिक सिद्धान्त के आधार पर संक्षारण की क्रियाविधि को लोहे पर जंग लगने के उदाहरण से निम्न प्रकार से आसानी से समझा जा सकता है। लोहे पर जंग लगने की क्रियाविधि-लोहे का संक्षारण उस समय होता है जब इसे जल, घुलित ऑक्सीजन तथा कार्बन डाइऑक्साइड युक्त वातावरण में रखा जाता है। विद्युत रासायनिक सिद्धान्त के अनुसार, लोहे की सतह के रासायनिक रूप से भिन्न भाग घुलित ऑक्सीजन तथा कार्बन डाइऑक्साइड युक्त जल की उपस्थिति में लघु गैल्वेनिक सेलों (miniature galvanic cells) की भाँति व्यवहार करते हैं। सतह का एक भाग ऐनोड की भाँति तथा कोई अन्य भाग कैथोड की भाँति कार्य करता है। इसके फलस्वरूप ऐनोडिक क्षेत्र (anodic area) में ऑक्सीकरण की क्रिया सम्पन्न होती है और आयरन परमाणु Fe2+ आयनों में ऑक्सीकृत हो जाते हैं।
ऐनोडिक क्षेत्र में –
![]()
इस प्रकार मुक्त इलेक्ट्रॉन धातु माध्यम में गति कर कैथोडिक क्षेत्र में पहुँच जाते हैं। कैथोडिक क्षेत्र में इलेक्ट्रॉन H+ आयनों की उपस्थिति में ऑक्सीजन को अपचयित करते हैं। H’ आयनों का निर्माण जल परत में H2CO3 के वियोजन के कारण होता है जो CO2 के जल में घुलने से प्राप्त होता है।
जल परत में– H2O(l) + CO2 (g) → H2CO3 (aq)
H2CO3 (aq) H+ (aq) + HCO–3 (aq)
कैथोडिक क्षेत्र में – O2 (g) + 4H+ (aq) + 4e– → 2H2O (l); E° = 1.23 V
इस प्रकार लोहे की सतह पर स्थित एक लघु गैल्वेनिक सेल में सम्पन्न होने वाली नेट अभिक्रिया को निम्न प्रकार से प्राप्त किया जा सकता है –
ऐनोड पर – [Fe(s) → Fe2+ (aq) + 2e– ] x 2
कैथोड पर – O2 (g) + 4H+ (aq) +4e– → 2H2O(l)
नेट अभिक्रिया –
2Fe(s) + O2(g) + 4H+ (aq) → 2Fe2+ (aq) + 2H2O(l); E° cell = 1.67 V
उपर्युक्त अभिक्रिया में निर्मित Fe2+ आयन लोहे की सतह पर स्थित जल परत में गति करने लगते हैं। यदि जल परत में NaCl, MgCl2 आदि विद्युत अपघट्य उपस्थित हैं तो लघु सेल में अधिक विद्युत धारा का संचालन होता है तथा जंग लगने की प्रक्रिया तीव्र हो जाती है।
एक लघु गैल्वेनिक सेल में निर्मित Fe2+ आयन वायुमण्डलीय ऑक्सीजन द्वारा Fe3+ आयनों में ऑक्सीकृत हो जाते हैं तथा वायुमण्डलीय ऑक्सीजन एवं नमी से संयोग कर जलयोजित आयरन (III) ऑक्साइड (Fe2O3 . xH2O) का निर्माण करते हैं जो लोहे की सतह पर जंग के रूप में जमा हो जाता है।
4Fe2+ (aq) + O2 (g) + 4H2O(l)-→ 2Fe2O3 (s) + 8H+

उपर्युक्त अभिक्रिया में उत्पन्न हुए H+ ओयन जंग लगने की प्रक्रिया में पुन: उपभोगित हो जाते हैं। यदि लोहे में कम विद्युत धनात्मक धातुएँ अशुद्धि के रूप में उपस्थित हैं तो जंग लगने की प्रक्रिया त्वरित हो जाती है क्योकि अशुद्धियाँ लोहे की सतह पर अनेक लघु गैल्वेनिक सेलों का निर्माण करती हैं। अत्यन्त शुद्ध लोहे पर शीघ्रता से जंग नहीं लगती है। जल में विद्युत अपघट्यों की उपस्थिति जंग प्रक्रिया को त्वरित करती है क्योंकि अपघट्य लोहे की सतह पर उपस्थित जल परत की विद्युत चालकता में वृद्धि करते हैं। यही कारण है कि आसुत जल की तुलना में समुद्री जल में लोहे पर अधिक तेजी से जंग लगती है।
संक्षारण से बचाव – संक्षारण से बचाव की कुछ प्रमुख विधियाँ निम्न हैं –
1. अवरोध रक्षण – लोहे को जंग लगने से बचाने के लिए इस विधि का काफी उपयोग किया जाता है। इस विधि में धातु सतह तथा वायुमण्डलीय वायु के मध्य एक उपयुक्त अवरोध का निर्माण किया जाता है! इससे धातु सतह वायु, जल तथा कार्बन डाइऑक्साइड की क्रिया से बची रहती है और संक्षारित नहीं होती है। अवरोध रक्षण निम्न में से किसी भी विधि द्वारा किया जा सकता है –
- धातु की सतह पर तेल या ग्रीस के लेपन द्वारा – लोहे की सतह पर तेल या ग्रीस (grease) की एक पतली फिल्म बनाकर उसे जंग लगने से बचाया जा सकता है। लोहे के औजारों तथा मशीनी भागों (machinery parts) को इसी प्रकार जंग लगने से बचाया जाता है।
- धातु सतह पर पेंट के लेपन द्वारा – धातु सतह पर किसी पेंट (paint), एनामिल (enamel) आदि का एक पतली परत के रूप में लेपन करने से धातु संक्षारित होने से बच जाती है।
- धातु पर कुछ विशिष्ट रसायनों के लेपन द्वारा – लोहे की सतह पर FePO4 या अन्य किसी उपयुक्त रसायन का लेप कर उसे जंग लगने से बचाया जा सकता है। रसायन की पतली अविलेय परत लोहे को वायु तथा नमी के सम्पर्क से बचाकर इस पर जंग नहीं लगने देती है।
- धातु पर असंक्षारणीय धातुओं की परत द्वारा – किसी असंक्षारणीय धातु; जैसे- निकिल, क्रोमियम आदि की एक पतली परत को किसी धातु पर चढ़ाकर भी उसकी संक्षारण से रक्षा की जा सकती है। जैसे, लोहे पर निकिल या क्रोमियम की एक पतली परत द्वारा लोहे को जंग लगने से बचाया जा सकता है।
2. बलिदानी रक्षण – इस विधि में धातु का रक्षण उसकी सतह पर लेपित एक अन्य अधिक सक्रिय धातु के बलिदान द्वारा किया जाता है। जब एक धातु की सतह को एक अधिक सक्रिय धातु से आवृत कर दिया जाता है, तो अधिक सक्रिय धातु प्रथम धातु की तुलना में वरीयता से इलेक्ट्रॉन त्याग कर आयनिक अवस्था में परिवर्तित होती रहती है। इससे अधिक सक्रिय धातु धीरे-धीरे उपभोगित होती रहती है और प्रथम धातु की संक्षारण से रक्षा करती है। जब तक अधिक सक्रिय धातु संक्षारणीय धातु की सतह पर स्थित होती है तब तक प्रथम धातु-संक्षारण से बची रहती है।
लोहे का गैल्वेनीकरण – जिंक लोहे से अधिक क्रियाशील (अधिक विद्युत धनात्मक) है, अत: जिंक का उपयोग प्राय: लोहे की सतह को आवृत करने के लिए किया जाता है। लोहे की सतह पर जिंक की एक पतली परत को जमा करने की प्रक्रिया को गैल्वेनीकरण कहा जाता है। गैल्वेनीकरण को निम्न दो प्रकार से सम्पन्न किया जा सकता है –
- लोहे को पिघले जिंक में डुबोकर – इस विधि में लोहे की चादरों को पिघले जिंक में डुबोया जाता है और इसके पश्चात् उन्हें गर्म रॉलरों (rollers) के मध्य से गुजारा जाता है, जिससे लोहे की चादर से चिपका अतिरिक्त जिंक हट जाता है और उस पर जिंक की एक समान पतली परत शेष रह जाती है।
- शेरार्डीकरण द्वारा – इस विधि में जिंक चूर्ण को उच्च ताप पर गर्म किया जाता है और प्राप्त जिंक वाष्प को लोहे की चादरों की सतह पर संघनित होने दिया जाता है, जिससे उन पर जिंक की एक
पतली तथा एक समान परत जमा हो जाती है।
लोहे की सतह पर स्थित जिंक की परत के कारण लोहे की सतह वायु तथा नमी के सम्पर्क में नहीं आने पाती है। जिंक की परत में खरोंच अथवा दरारें उत्पन्न होने पर भी लोहे पर जंग नहीं लगती है। इसका कारण यह है कि जिंक का मानक अपचयन विभव लोहे के मानक अपचयन विभव से कम है। स्पष्ट है कि लोहे की तुलना में जिंक में ऑक्सीकृत होने की प्रवृत्ति अधिक होती है। जिंक परत में दरार पड़ने पर जिंक परत ऐनोड की भाँति तथा लोहे की खुली सतह कैथोड की भाँति कार्य करने लगती है। ऐनोड पर जिंक के ऑक्सीकरण में उत्सर्जित इलेक्ट्रॉन आयरन कैथोड पर जाकर वायुमण्डलीय ऑक्सीजन को जल में अपचयित कर देते हैं। ऑक्सीकरण के कारण जिंक परत वायुमण्डलीय O2, CO2 तथा नमी की उपस्थिति में भास्मिक जिंक कार्बोनेट, ZnCO3, Zn(OH)2 में परिवर्तित हो जाती है। यह परत लोहे की खुली सतह को जंग लगने से बचाती है।
टिन द्वारा लोहे की रक्षण – लोहे की सतह पर टिन की एक पतली परत जमाकर भी उसकी जंग लगने से रक्षा की जा सकती है। लोहे की सतह को टिन की एक पतली परत से आवृत करने की प्रक्रिया को टिनिंग (tinning) कहा जाता है। टिनिंग द्वारा लोहा (आयरन) उस समय तक रक्षित रहता है जब तक कि टिन परत अक्षुण (intact) रहती है। यदि टिन परत में खरोंच या दरारें उत्पन्न हो जाती हैं तो लोहा आरक्षित हो जाता है और उस पर जंग लगना प्रारम्भ हो जाता है। इसका कारण यह है कि आयरन का मानक अपचयन विभव टिन से कम है।
इससे स्पष्ट है कि टिन की तुलना में आयरन में ऑक्सीकृत होने की प्रवृत्ति अधिक होती है। अत: यदि टिन परत में दरार उत्पन्न हो जाती है तो सतह के खुले भाग में उपस्थित आयरन एक ऐनोड का तथा टिन परत एक कैथोड का कार्य करने लगती है। इसके फलस्वरूप आयरन वरीयता से ऑक्सीकृत होकर जंग ग्रस्त हो जाता है।
3. जंग-रोधी विलयनों द्वारा रक्षण – लोहे के संक्षारण को जंग-रोधी विलयनों द्वारा भी रोका जा सकता है। इस प्रकार के विलयन प्रायः क्षारीय फॉस्फेट या क्रोमेट विलयन होते हैं। विलयन का क्षारीय माध्यम H+ आयनों की उपलब्धता को कम करता है। चूंकि H+ आयन जंग लगने के लिए अपरिहार्य हैं, अतः उनके कम होने से जंग लगने की प्रक्रिया मन्द हो जाती है। इसके अतिरिक्त फॉस्फेटों में धातु पर आयरन फॉस्फेट की एक परत का आवरण चढ़ाने की प्रवृत्ति होती है। यह परत धातु की जंग लगने से रक्षा करती है। इस प्रकार के विलयनों का प्रयोग स्वचालित वाहनों के इंजनों के भागों को तथा कार रेडियेटरों की जंग लगने से रक्षा करने के लिए किया जाता है।
4. कैथोडिक रक्षण या विद्युत रक्षण – इस विधि का उपयोग धरातल के नीचे दबे पाइपों तथा टैंकों के रक्षण के लिए किया जाता है। इस विधि में रक्षित की जाने वाली धातु को एक अधिक सक्रिय (अधिक विद्युत धनात्मक) धातु से जोड़ा जाता है।
धरातल के नीचे स्थित जिस लोहे के पाइप या टैंक की जंग लगने से रक्षा करनी होती है उसके निकट एक सक्रिय धातु जैसे Zn या Mg की एक प्लेट या ब्लॉक को रखा जाता है और दोनों को एक तार से जोड़ दिया जाता है। चूंकि अधिक सक्रिय धातु में ऑक्सीकृत होने की प्रवृत्ति अधिक होती है। अत: यह लोहे की तुलना में वरीयती से ऑक्सीकृत होती रहती है। इस प्रकार अधिक सक्रिय धातु एक ऐनोड का कार्य करती है। उत्सर्जित इलेक्ट्रॉन कैथोड की भाँति कार्य कर रहे लोहे के पाइप पर जाकर O, को OH– आयनों में अपचयित कर देते हैं।
O2 + 2H2O + 4e– → 4OH–
सक्रिय धातु के ऑक्सीकरण के कारण ऐनोड धीरे-धीरे लुप्त होता रहता है। इस प्रकार लोहे का पाइप या अन्य वस्तु जंग लगने से रक्षित रहती है और सक्रिय धातु ऐनोड व्यतित होता रहता है। जब तक सक्रिय धातु उपस्थित होती है, लोहे के पाइप पर जंग नहीं लगती है। इस विधि में समय-समय पर सक्रिय धातु के पुराने ऐनोड के स्थान पर नया ऐनोड स्थापित करना आवश्यक होता है।
We hope the UP Board Solutions for Class 12 Chemistry Chapter 3 Electro Chemistry (वैद्युत रसायन) help you.