UP Board Solutions for Class 12 Chemistry Chapter 4 Chemical Kinetics (रासायनिक बलगतिकी)
UP Board Solutions for Class 12 Chemistry Chapter 4 Chemical Kinetics (रासायनिक बलगतिकी)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
R → P, अभिक्रिया के लिए अभिकारक की सान्द्रता 0.03 M से 25 मिनट में परिवर्तित होकर 0.02 M हो जाती है। औसत वेग की गणना सेकण्ड तथा मिनट दोनों इकाइयों में कीजिए।
हल
R → P अभिक्रिया के लिए,

प्रश्न 2.
2A → उत्पाद, अभिक्रिया में A की सान्द्रता 10 मिनट में 0.5 mol L-1 से घटकर 0.4 mol L-1 रह जाती है। इस समयान्तराल के लिए अभिक्रिया वेग की गणना कीजिए।
हल
2A → उत्पाद, अभिक्रिया के लिए औसत वेग

प्रश्न 3.
एक अभिक्रिया A + B → उत्पाद, के लिए वेग नियम r = k [A]1/2 [B]2 से दिया गया है। अभिक्रिया की कोटि क्या है?
हल
अभिक्रिया की कोटि = [latex s=2]\frac { 1 }{ 2 } [/latex] + 2 = 2.5
प्रश्न 4.
अणु X का Y में रूपान्तरण द्वितीय कोटि की बलगतिकी के अनुरूप होता है। यदि X की सान्द्रता तीन गुनी कर दी जाए तो Y के निर्माण होने के वेग पर क्या प्रभाव पड़ेगा?
हल
अभिक्रिया X → Y के लिए।
अभिक्रिया का वेग (r) = k[X]2
यदि सान्द्रता तीन गुनी कर दी जाये तब
अभिक्रिया का वेग (r‘) = [3X]2
[latex s=2]\frac { { r }^{ ‘ } }{ r } =\frac { { k[3X] }^{ 2 } }{ { k[X] }^{ 2 } }=9 [/latex]
अत: Y के निर्माण का वेग 9 गुना बढ़ जायेगा।
प्रश्न 5.
एक प्रथम कोटि की अभिक्रिया का वेग स्थिरांक 1.15 x 10-3 s-1 है। इस अभिक्रिया में अभिकारक की 5g मात्रा को घटकर 3g होने में कितना समय लगेगा?
हल
प्रथम कोटि अभिक्रिया के लिए,
[latex s=2]t=\frac { 2.303 }{ k } log\frac { a }{ (a-x) }[/latex]
a = 5 g; (a – x) = 3g; k= 1.15 x 10-3 s-1
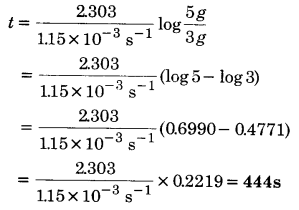
प्रश्न 6.
SO2Cl2 को अपनी प्रारम्भिक मात्रा से आधी मात्रा में वियोजित होने में 60 मिनट का समय लगता है। यदि अभिक्रिया प्रथम कोटि की हो तो वेग स्थिरांक की गणना कीजिए।
हल
प्रथम कोटि की अभिक्रिया के लिए,
[latex s=2]k=\frac { 0.693 }{ { t }_{ 1/2 } } =\frac { 0.693 }{ 60min } [/latex] = 1.155 × 10-2 min-1
= [latex s=2]\frac { 0.693 }{ 60\times 60s } [/latex] = 1.925 × 10-4 s-1
प्रश्न 7.
ताप का वेग स्थिरांक पर क्या प्रभाव होगा?
उत्तर
सामान्यतः अभिक्रिया का वेग स्थिरांक 10°C ताप बढ़ाने पर लगभग दोगुना हो जाता है। वेग स्थिरांक की ताप पर सटीक निर्भरता आरेनियस समीकरण k = Ae-Ea/RT द्वारा दी जाती है जहाँ A आवृत्ति गुणांक तथा E, अभिक्रिया की सक्रियण ऊर्जा है।
प्रश्न 8.
परमताप, 298 K में 10 K की वृद्धि होने पर रासायनिक अभिक्रिया का वेग दुगुना हो जाता है। इस अभिक्रिया के लिए Ea की गणना कीजिए।
या
एक रासायनिक अभिक्रिया का ताप 290 K से बढ़ाकर 300 K करने पर अभिक्रिया की दर दोगुनी हो जाती है? अभिक्रिया की सक्रियण ऊर्जा का मान ज्ञात कीजिए।
(दिया है-R = 8314 JK-1 मोल-1 ; log 102 = 0.3010) (2018)
हल
आरेनियस समीकरण के अनुसार,

प्रश्न 9.
581 K ताप पर अभिक्रिया 2 HI (g) → H2 (g) + I2 (g) के लिए सक्रियण ऊर्जा को मान 209.5 kJ mol-1 है। अणुओं के उस अंश की गणना कीजिए जिसकी ऊर्जा सक्रियण ऊर्जा के बराबर अथवा इससे अधिक है।
हल
अणुओं का वह अंश जिसकी ऊर्जा सक्रियण ऊर्जा के बराबर या अधिक है।

अतिरिक्त अभ्यास
प्रश्न 1.
निम्नलिखित अभिक्रियाओं के वेग व्यंजकों से इनकी अभिक्रिया कोटि तथा वेग स्थिरांकों की इकाइयाँ ज्ञात कीजिए –
- 3NO (g) → N2O (g) वेग = k [NO]2
- H2O2 (aq) + 3I– (aq) + 2H+ → 2H2O(l) + I–3 वेग = k [H2O2] [I–]
- CH3CHO (g) → CH4 (g)+ CO (g) वेग = k [CH3CHO]3/2
- C2H5Cl (g) → C2H4 (g) + HCl (g) वेग = k [C2H5Cl]
उत्तर
- द्वितीय कोटि,L mol-1 time-1
- farite alfa, L mol-1 time-1
- 3/2 कोटि, L1/2 mol-1/2 time-1
- प्रथम कोटि, time-1
प्रश्न 2.
अभिक्रिया 2A + B → A2B के लिए वेग = k[Al [B]2 यहाँ ६का मान 2.0 x 10-6 mol-2 L2 s-1 है। प्रारम्भिक वेग की गणना कीजिए; जब [A]= 0.1 mol L-1 एवं [B] = 0.2 mol L-1 हो तथा अभिक्रिया वेग की गणना कीजिए; जब [A] घटकर 0.06 mol L-1 रह जाए।
हल

प्रश्न 3.
प्लैटिनम सतह पर NH3 का अपघटन शून्य कोटि की अभिक्रिया है। N2 एवं H2 के उत्पादन की दर क्या होगी जब ६ का मान 25 x 10-4 mol L-1 s-1 हो?
हल

प्रश्न 4.
डाइमेथिल ईथर के अपघटन से CH4, H2 तथा CO बनते हैं। इस अभिक्रिया का वेग निम्नलिखित समीकरण द्वारा दिया जाता है –
वेग = k [CH3OCH3]3/2
अभिक्रिया के वेग का अनुगमन बन्द पात्र में बढ़ते दाब द्वारा किया जाता है, अतः वेग समीकरण को डाइमेथिल ईथर के आंशिक दाब के पद में भी दिया जा सकता है। अतः
वेग = k(PCH3OCH3)3/2
यदि दाब को bar में तथा समय को मिनट में मापा जाए तो अभिक्रिया के वेग एवं वेग स्थिरांक की इकाइयाँ क्या होंगी?
उत्तर

प्रश्न 5.
रासायनिक अभिक्रिया के वेग पर प्रभाव डालने वाले कारकों का उल्लेख कीजिए।
या
किसी रासायनिक अभिक्रिया के क्षेत्र को ताप किस प्रकार प्रभावित करता है? (2018)
हल
निम्नलिखित कारक अभिक्रिया के वेग को प्रभावित करते हैं –
- सान्द्रण (Concentration) – गतिज आण्विक सिद्धान्त के अनुसार आण्विक अभिक्रियाएँ अणुओं के परस्पर टकराने से होती हैं। अभिकारक का सान्द्रण बढ़ने से अणुओं की संख्या में वृद्धि होती है जिसके फलस्वरूप इकाई समय में अणुओं के आपस में टकराने की सम्भावना बढ़ने से अभिक्रिया का वेग भी बढ़ जाता है।
- ताप (Temperature) – ताप की वृद्धि से सक्रिय अणुओं तथा प्रभावकारी टक्करों की संख्या में, वृद्धि हो जाती है जिससे अभिक्रिया का वेग बढ़ जाता है।
- दाब (Pressure) – दाब बढ़ने से गैसीय अणु निकट आ जाते हैं जिसके फलस्वरूप उनके परस्पर टकराने की सम्भावना बढ़ जाती है अर्थात् वेग बढ़ जाता है।
- अभिकारकों के पृष्ठ क्षेत्रफल का प्रभाव (Effect of surface area of reactants) – अभिकारक पदार्थों की भौतिक अवस्था का प्रभाव विषमांग अभिक्रिया पर पड़ता है जैसे- लकड़ी के लट्टे की तुलना में लकड़ी का बुरादा तीव्रता से जलता है। अम्लों के साथ धातुओं की तुलना में धातु चूर्ण अधिक तीव्र वेग से क्रिया करते हैं अर्थात् पृष्ठ क्षेत्रफल बढ़ने पर अभिक्रिया का वेग बढ़ता है।
- उत्प्रेरक का प्रभाव (Effect of catalyst) – उत्प्रेरक वे पदार्थ हैं, जो रासायनिक अभिक्रिया की गति को प्रभावित करते हैं। इसकी उपस्थिति में अभिक्रिया का वेग अधिक या कम हो जाता है जो उत्प्रेरक की प्रकृति पर निर्भर करता है।
- अभिकारकों की प्रकृति पर (On the nature of reactants) – यदि अभिकारक आयनिक है तो उस अभिक्रिया का वेग अनायनिक अभिक्रियाओं के वेग से अधिक होता है।
प्रश्न 6.
किसी अभिक्रियक के लिए एक अभिक्रिया द्वितीय कोटि की है। अभिक्रिया का वेग कैसे प्रभावित होगा, यदि अभिक्रियक की सान्द्रता –
- दुगुनी कर दी जाए,
- आधी कर दी जाए?
उत्तर
प्रश्नानुसार, वेग (r0) = k [A]2 यदि A की सान्द्रता को दो गुना किया जाये
तब r1 = k [2A]2 = 4r0
यदि आधा कर दिया जाये, तब r2 = [A/2]2, r2 = 1/4r0
प्रश्न 7.
वेग स्थिरांक पर ताप का क्या प्रभाव पड़ता है? ताप के इस प्रभाव को मात्रात्मक रूप में कैसे प्रदर्शित कर सकते हैं?
उत्तर
अभिक्रिया का वेग स्थिरांक सदैव ताप बढ़ाने पर बढ़ता है। ताप में 10°C की वृद्धि पर इसका मान लगभग दोगुना हो जाता है। इसे मात्रात्मक रूप में निम्न प्रकार प्रदर्शित करते हैं –
k = Ae-Ea/RT
जहाँ = ताप T पर वेग स्थिरांक है, A= आवृत्ति गुणांक तथा E,= सक्रियण ऊर्जा
प्रश्न 8.
जल में एस्टर के छद्म प्रथम कोटि के जल-अपघटन से निम्नलिखित आँकड़े प्राप्त हुए –

(i) 30 से 60 सेकण्ड के समय-अन्तराल में औसत वेग की गणना कीजिए।
(ii) एस्टर के जल-अपघटन के लिए छद्म प्रथम कोटि की अभिक्रिया के वेग स्थिरांक की गणना कीजिए।
हल

प्रश्न 9.
एक अभिक्रिया A के प्रति प्रथम तथा B के प्रति द्वितीय कोटि की है।
- अवकल वेग समीकरण लिखिए।
- B की सान्द्रता तीन गुनी करने से वेग पर क्या प्रभाव पड़ेगा?
- A तथा B दोनों की सान्द्रता दुगुनी करने से वेग पर क्या प्रभाव पड़ेगा?
उत्तर
- वेग = k [A]1 [B]2
- r0 = k [A]1 [B]2, r1 = k[A]1 [3B]2, r1 = 9 x r0
- r0 = k [A]1 [B]2, r2 = k[2A] [2B]2, r2 = 8 x r0
प्रश्न 10.
A और B के मध्य अभिक्रिया में A और B की विभिन्न प्रारम्भिक सान्द्रताओं के लिए प्रारम्भिक वेग (r0) नीचे दिए गए हैं –
A और B के प्रति अभिक्रिया की कोटि क्या है?

हल

प्रश्न 11.
2A + B → C+ D अभिक्रिया की बलगतिकी अध्ययन करने पर निम्नलिखित परिणाम प्राप्त हुए। अभिक्रिया के लिए वेग नियम तथा वेग स्थिरांक ज्ञात कीजिए।

हल
प्रयोग I तथा IV में [B] समान है लेकिन [A] चार गुना हो गया है तथा अभिक्रिया का वेग भी चार गुना हो गया है।
∴ A के सापेक्ष वेग ∝ [A] …..(i)
प्रयोग II तथा III में [A] समान है लेकिन [B] दोगुना हो गया है तथा अभिक्रिया का वेग । भी चार गुना हो गया है।
B के सापेक्ष वेग ∝ [B]2 …..(ii)
समीकरण (i) तथा (ii) को संयुक्त करने पर हमें अभिक्रिया 2A + B → C + D का वेग नियम प्राप्त हो जाता है।
वेग = k [A] [B]2
अभिक्रिया की समग्र कोटि = 1 + 2 = 3
वेग स्थिरांक की गणना :
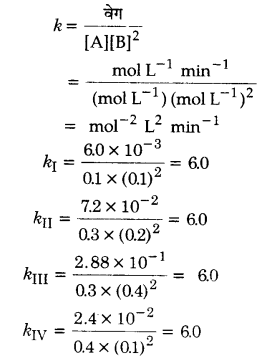
अतः वेग स्थिरांक = 6.0 mol-2 L2 min-1
प्रश्न 12.
A तथा B के मध्य अभिक्रिया A के प्रति प्रथम तथा B के प्रति शून्य कोटि की है। निम्नांकित तालिका में रिक्त स्थान भरिए –

हल
अभिक्रिया के लिए वेग व्यंजक, वेग = k [A]1 [B]0 = k [A]
प्रयोग I: 2.0 x 10-2 mol L-1 min-1 = k (0.1 M)
या k= 0.2 min-1
प्रयोग II : 4.0 x 10-2 mol L-1 min-1 = 0.2 min-1 [A]
या k= 0.2 mol L-1
प्रयोग III: वेग = (0.2 min-1) (0.4 mol L-1)
= 0.08 mol L-1 min-1
प्रयोग IV: 2.0 x 10-2 mol L-1 min-1
= 0.2 min-1 [A]
या [A] = 0.1 mol L-1
प्रश्न 13.
नीचे दी गई प्रथम कोटि की अभिक्रियाओं के वेग स्थिरांक से अर्द्ध-आयु की गणना कीजिए –
- 200 s-1
- 2 min-1
- 4 year-1
हल
- [latex s=2]{ t }_{ 1/2 }=\frac { 0.693 }{ k } =\frac { 0.693 }{ 200 } [/latex] = 3.465 x 10-3 s
- [latex s=2]{ t }_{ 1/2 }=\frac { 0.693 }{ k } =\frac { 0.693 }{ 2 } [/latex] = 3.465 x 10-1 min
- [latex s=2]{ t }_{ 1/2 }=\frac { 0.693 }{ k } =\frac { 0.693 }{ 4 } [/latex] = 1.733 x 10-1 yr
प्रश्न 14.
14C के रेडियोऐक्टिव क्षय की अर्द्ध-आयु 5730 वर्ष है। एक पुरातत्व कलाकृति की लकड़ी में, जीवित वृक्ष की लकड़ी की तुलना में 80% 14C की मात्रा है। नमूने की आयु का परिकलन कीजिए।
हल

प्रश्न 15.
गैस प्रावस्था में 318 K पर N,05 के अपघटन की अभिक्रिया
[2N2O → 4NO2 + O2] के आँकडे नीचे दिए गए हैं –
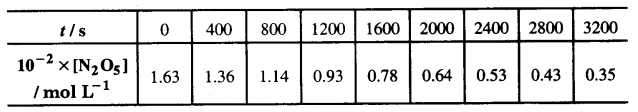
(i) [N2O5] एवं t के मध्य आलेख खींचिए।
(ii) अभिक्रिया के लिए अर्द्ध-आयु की गणना कीजिए।
(iii) log [N2O5] एवं t के मध्य ग्राफ खींचिए।
(iv) अभिक्रिया के लिए वेग नियम क्या है?
(v) वेग स्थिरांक की गणना कीजिए।
(vi) k की सहायता से अर्द्ध-आयु की गणना कीजिए तथा इसकी तुलना (ii) से कीजिए।
हल


(iv) log [N2O5] तथा समय के मध्य ग्राफ एक सीधी रेखा है अत: यह प्रथम कोटि की अभिक्रिया है। अतः वेग नियम होगा –
वेग = k [N2O5]

प्रश्न 16.
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक 60 s-1 है। अभिक्रियक को अपनी प्रारम्भिक सान्द्रता से वाँ भाग रह जाने में कितना समय लगेगा?
हल

प्रश्न 17.
नाभिकीय विस्फोट का 28.1 वर्ष अर्द्ध-आयु वाला एक उत्पाद 90Sr होता है। यदि कैल्सियम के स्थान पर 1µg, 90Sr नवजात शिशु की अस्थियों में अवशोषित हो जाए और उपापचयन से ह्रास न हो तो इसकी 10 वर्ष एवं 60 वर्ष पश्चात कितनी मात्रा रह जाएगी?
हल

प्रश्न 18.
दर्शाइए कि प्रथम कोटि की अभिक्रिया में 99% अभिक्रिया पूर्ण होने में लगा समय 90% अभिक्रिया पूर्ण होने में लगने वाले समय से दुगुना होता है।
हल

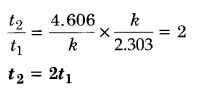
प्रश्न 19.
एक प्रथम कोटि की अभिक्रिया में 30% वियोजन होने में 40 मिनट लगते हैं। t1/2 की गणना कीजिए।
हल
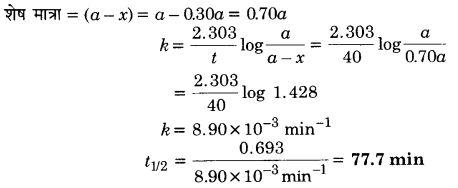
प्रश्न 20.
543 K ताप पर एजोआइसोप्रोपेन के हेक्सेन तथा नाइट्रोजन में विघटन के निम्नांकित आँकड़े प्राप्त हुए। वेग स्थिरांक की गणना कीजिए।
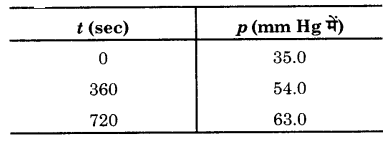
हल
ऐजोआइसोप्रोपेन निम्न समीकरण के अनुसार विघटित होता है –
(CH3)2CHN = NCH(CH3)2 (g) → N2 (g) + C6H14 (g)
यह क्रिया प्रथम कोटि की है।
प्रारम्भिक दाब P0 = 35.0 mm Hg
t समय बाद ऐजोआइसोप्रोपेन के दाब में कमी = P
N2 के दाब में वृद्धि = PN2
हेक्सेन के दाब में वृद्धि =PC6 H14
मिश्रण का कुल दाब Pt = PA + PN2 + PC6 H14
Pt = (P0 – P) + P + P = P0 + P
P = Pt – P0
PA = P0 – (Pt – P0) = 2P0 – Pt


प्रश्न 21.
स्थिर आयतन पर, SO2Cl2 के प्रथम कोटि के ताप अपघटन पर निम्नांकित आँकड़े प्राप्त हुए –
SO2Cl2 (g) → SO2 (g) + Cl2 (g)
अभिक्रिया वेग की गणना कीजिए जब कुल दाब 0.65 atm हो।
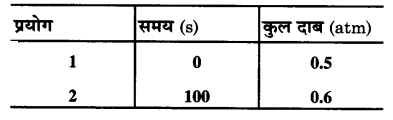
हल

प्रश्न 22.
विभिन्न तापों पर N2O5 के अपघटन के लिए वेग स्थिरांक नीचे दिए गए हैं –

In k एवं 1/T के मध्य ग्राफ खींचिए तथा A एवं E, की गणना कीजिए। 30°C तथा 50°C पर वेग स्थिरांक को प्रागुक्त कीजिए।
हल
log k तथा 1/T के मध्य ग्राफ खींचने के लिए, हम दिए गए आँकड़ों को अग्रलिखित प्रकार से लिख सकते हैं –
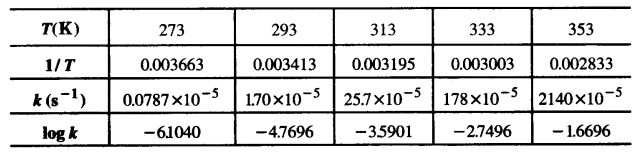
उपर्युक्त मानों पर आधारित ग्राफ निम्नांकित चित्र में प्रदर्शित है –


इस समीकरण की तुलना y = mx + c से करते हैं जो अन्त:खण्डे रूप में रेखा की समीकरण है।
log A= Y- अक्ष पर अर्थात् k अक्ष पर अन्त:खण्ड का मान
= (-1 + 7.2) = 6.2 [y2 – y1 = – 1 – (-7.2)]
आवृत्ति गुणक A = Antilog 6.2
= 1585000
= 1.585 x 106 collisions s-1
वेग स्थिरांक के मान ग्राफ से निम्नलिखित प्रकार प्राप्त किए जा सकते हैं –

प्रश्न 23.
546 K ताप पर एक हाइड्रोकार्बन के अपघटन में वेग स्थिरांक 2.418 x 10-5 s-1 है। यदि सक्रियण ऊर्जा 179.9 kJ mol-1 हो तो पूर्व-घातांकी गुणन का मान क्या होगा?
हल

प्रश्न 24.
किसी अभिक्रिया A→ उत्पाद के लिए = 2.0 x 10-2 s-1 है। यदि A की प्रारम्भिक सान्द्रता 1.0 mol L-1 हो तो 100 s पश्चात इसकी सान्द्रता क्या रह जाएगी?
हल

प्रश्न 25.
अम्लीय माध्यम में सुक्रोस का ग्लूकोस एवं फ्रक्टोस में विघटन प्रथम कोटि की अभिक्रिया है। इस अभिक्रिया की अर्द्ध-आयु 3.0 घण्टे है। 8 घण्टे बाद नमूने में सुक्रोस का कितना अंश बचेगा?
हल
k = [latex s=2]\frac { 0.693 }{ k } [/latex] = 0.231 hr-1
माना सुक्रोस की प्रारम्भिक सान्द्रता 1 M है।
माना सुक्रोस का 8 घण्टे पश्चात् सान्द्रण (1 – x) M है।
[latex s=2]k=\frac { 1 }{ { t }_{ 2 }-{ t }_{ 1 } } ln\frac { 1 }{ 1-x } [/latex]

प्रश्न 26.
हाइड्रोकार्बन का विघटन निम्नांकित समीकरण के अनुसार होता है। Ea की गणना कीजिए।
k= (4.5 x 1011 s-1) e-28000 K/T
हल
आरेनियस समीकरण के अनुसार, k = Ae-Ea/RT
∴ [latex s=2]-\frac { { E }_{ a } }{ RT } =-\frac { 28000K }{ T } [/latex]
E = 28000 K x R=28000 K x 8.314 JK-1 mol-1
= 232.79 kJ mol-1
प्रश्न 27.
H2O2 के प्रथम कोटि के विघटन को निम्नांकित समीकरण द्वारा लिख सकते हैं –
log k = 14.34 – 1.25 x 104 K/T
इस अभिक्रिया के लिए E, की गणना कीजिए। कितने ताप पर इस अभिक्रिया की अर्द्ध -आयु 256 मिनट होगी?
हल
(i) log k = log A – [latex s=2]\frac { { E }_{ a } }{ 2.303RT } [/latex]

प्रश्न 28.
10°C ताप पर A के उत्पाद में विघटन के लिए का मान 4.5 x 103 s-1 तथा सक्रियण ऊर्जा 60 kJ mol-1 है। किस ताप पर B का मान 1.5 x 104 s-1 होगा?
हल

प्रश्न 29.
298 K ताफ्पर प्रथम कोटि की अभिक्रिया के 10% पूर्ण होने का समय 308 K ताप पर 25% अभिक्रिया पूर्ण होने में लगे समय के बराबर है। यदि A का मान 4 x 1010 s-1 हो तो 318 K ताप पर है तथा Ea की गणना कीजिए।
हल



प्रश्न 30.
ताप में 293 K से 313 K तक वृद्धि करने पर किसी अभिक्रिया का वेग चार गुना हो जाता | है। इस अभिक्रिया के लिए सक्रियण ऊर्जा की गणना यह मानते हुए कीजिए कि इसका मान ताप के साथ परिवर्तित नहीं होता।
हल

परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
[latex s=2]\frac { dx }{ dt } [/latex] ∝ [a]° की अभिक्रिया की कोटि है – (2017)
(i) शून्य
(ii) प्रथम
(iii) द्वितीय
(iv) इनमें से कोई नहीं
उत्तर
(i) शून्य।
प्रश्न 2.
शून्य कोटि अभिक्रिया के दर-नियतांक का मात्रक है – (2015)
(i) लीटर-सेकण्ड-1
(ii) लीटर-मोल-1 सेकण्ड-1
(iii) मोल-लीटर-1 सेकण्ड-1
(iv) मोल-सेकण्ड-1
उत्तर
(iii) मोल-लीटर-1 सेकण्ड-1
प्रश्न 3.
शून्य कोटि की अभिक्रिया के लिए निम्नलिखित में से कौन-सा सूत्र सही है? (2017)
(i) t1/2 ∝ a
(ii) t1/2 ∝ [latex s=2]\frac { 1 }{ a } [/latex]
(iii) t1/2 ∝ [latex s=2]\frac { 1 }{ { a }^{ 2 } } [/latex]
(iv) t1/2 ∝ a0
उत्तर
(iv) t1/2 ∝ a0
प्रश्न 4.
प्रथम कोटि की अभिक्रिया के वेग नियतांक का मात्रक है – (2017)
(i) मोल ली०-1 सेकण्ड-1
(ii) ली० मो-1 सेकण्ड-1
(iii) सेकण्ड-1
(iv) मोल लीटर-1
उत्तर
(iii) सेकण्ड-1
प्रश्न 5.
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक (A) का समीकरण है – (2011, 12)

प्रश्न 6.
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक तथा अर्द्ध आयुकाल में सम्बन्ध है – (2017)
(i) [latex s=2]k=\frac { 0.6932 }{ { t }_{ 1/2 } }[/latex]
(ii) [latex s=2]k=\frac { { t }_{ 1/2 } }{ 0.6932 } [/latex]
(iii) [latex s=2]{ t }_{ 1/2 }=0.6932k[/latex]
(iv) [latex s=2]{ t }_{ 1/2 }=\frac { k }{ 0.6932 }[/latex]
उत्तर
(i) [latex s=2]k=\frac { 0.6932 }{ { t }_{ 1/2 } }[/latex]
प्रश्न 7.
प्रथम कोटि की अभिक्रिया में अर्द्ध भाग के पूर्ण होने में लगा समय (t1/2) – (2013, 15)
(i) उसकी प्रारम्भिक सान्द्रता पर निर्भर करता है।
(ii) उसकी प्रारम्भिक सान्द्रता के व्युत्क्रमानुपाती है।
(iii) उसकी प्रारम्भिक सान्द्रता पर निर्भर नहीं करता है।
(iv) उसकी प्रारम्भिक सान्द्रता के वर्गमूल पर निर्भर करता है।
उत्तर
(iii) उसकी प्रारम्भिक सान्द्रता पर निर्भर नहीं करता है।
प्रश्न 8.
प्रथम कोटि की एक अभिक्रिया 72 मिनट में 75% पूर्ण होती है। कब आधी (50%) अभिक्रिया पूर्ण हुई? (2016)
(i) 36 मिनट में
(ii) 48 मिनट में
(iii) 52 मिनट में
(iv) 144 मिनट में
उत्तर
(i) 36 मिनट में।
प्रश्न 9.
यदि किसी प्रथम कोटि की अभिक्रिया का 90%, 90 मिनट में पूर्ण हुआ हो, तो इसके 50% पूर्ण होने में लगने वाला समय होगा (log 2= 0.30) (2016)
(i) 30मिनट
(ii) 36 मिनट
(iii) 50 मिनट
(iv) 27 मिनट
उत्तर
(iv) 27 मिनट
प्रश्न 10.
प्रथम कोटि की अभिक्रिया के 90% पूर्ण होने में लगने वाला समय लगभग होता है – (2018)
(i) अर्द्धआयु का 2.2 गुना
(ii) अर्द्धआयु का 4.4 गुना
(iii) अर्द्धआयु का 3.3 गुना
(iv) अर्द्धआयु का 1.1 गुना
उत्तर
(iii) अर्द्धआयु का 3.3 गुना
प्रश्न 11.
निम्नलिखित में कौन-सी अभिक्रिया आभासी एकाणुक है? (2009, 11, 16)
(i) CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
(ii) CH3COOCH3 + H2O → CH2COOH+ CH3OH
(iii) 2 FeCl3 + SnCl2 → 2FeCl2 + SnCl4
(iv) H2 + Cl2 → 2HCl
उत्तर
(ii) CH3COOCH3 + H2O → CH3COOH+ CH3OH
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
- अभिक्रिया का वेग क्या है? (2018)
- अभिक्रिया की तात्क्षणिक दर को परिभाषित कीजिए। (2017)
उत्तर
1. वह देर, जिस पर समय के साथ-साथ अभिकारक पदार्थों का सान्द्रण परिवर्तित होता है, अभिक्रिया का वेग कहलाता है।”
यदि सूक्ष्म अन्तराल dt में अभिकारक के dr मोल उत्पाद में परिवर्तित होते हों तो
अभिक्रिया का वेग = [latex s=2]\frac { dx }{ dt } [/latex]
यदि अन्तराल dt में अभिकारक के de मोल शेष रहते हों तो
अभिक्रिया का वेग = [latex s=2]-\frac { d[c] }{ dt } [/latex]
2. किसी निश्चित क्षण पर किसी एक अभिकारक अथवा उत्पाद के सान्द्रता परिवर्तन की दर (अथवा इकाई समय में सान्द्रता परिवर्तन) उस क्षण पर अभिक्रिया की दर अर्थात् अभिक्रिया की तात्क्षणिक दर कहलाती है।
वास्तव में, तात्क्षणिक दर लघुतम सम्भव समय अन्तराल (जब Δt शून्य की ओर अग्रसर हो) के दौरान औसत दर होती है। यदि किसी लघुतम समय अन्तराल dt में होने वाला लघुतम सान्द्रता परिवर्तन dx है तो
rinst = [latex s=2]\frac { dx }{ dt } [/latex]
प्रश्न 2.
वेग नियम को परिभाषित कीजिए।
उत्तर
वह गणितीय व्यंजक जो अभिकारकों की मोलर सान्द्रता पर अभिक्रिया के वेग की प्रायोगिक निर्भरता को व्यक्त करता है, वेग नियम कहलाता है। यदि एक सामान्य अभिक्रिया
aA+ bB → उत्पाद
का वेग A की सान्द्रता की घात p तथा B की सान्द्रता की घात q पर निर्भर करता है, तो
वेग = k [A]p [B]q
जहाँ k वेग स्थिरांक अथवा दर स्थिरांक है।
उपर्युक्त समीकरण को ही वेग नियम कहते हैं।
प्रश्न 3.
वेग नियम और द्रव्य अनुपाती क्रिया के नियम में क्या अन्तर है?
उत्तर
वेग नियम के अनुसार, अभिक्रिया का वेग उन सान्द्रता पदों पर निर्भर करता है,जिन पर अभिक्रिया , का वेग वास्तव में निर्भर करता है (प्रयोगों द्वारा ज्ञात) जबकि द्रव्य अनुपाती क्रिया का नियम सन्तुलित रासायनिक समीकरण की स्टॉइकियोमीट्री पर आधारित है।
उदाहरणार्थ-किसी सामान्य अभिक्रिया aA+ bB → उत्पाद के लिए,
वेग नियम के अनुसार, वेग = k[A]p [B]q
जबकि द्रव्य अनुपाती क्रिया नियम के अनुसार, वेग = k[A]a [B]b
प्रश्न 4.
अभिक्रिया का वेग स्थिरांक क्या है? (2009, 12, 17)
उत्तर
यदि किसी रासायनिक अभिक्रिया में किसी क्षण अभिकारक का आण्विक सान्द्रण C हो, तो उस समय अभिक्रिया का वेग [latex s=2](\frac { dx }{ dt } )[/latex], सान्द्रण C के समानुपाती होता है,
अर्थात् [latex s=2]\frac { dx }{ dt } [/latex] ∝ C या [latex s=2]\frac { dx }{ dt } [/latex] = kC
जहाँ, k एक स्थिरांक है, जिसे वेग स्थिरांक कहते हैं।
अब यदि C= 1 तो [latex s=2]\frac { dx }{ dt } [/latex] = k
अतः स्थिर ताप पर अभिकारक पदार्थ के इकाई सान्द्रण पर होने वाले अभिक्रिया के वेग को उसे अभिक्रिया का वेग स्थिरांक कहते हैं।
प्रश्न 5.
वेग स्थिरांक तथा साम्य स्थिरांक में अन्तर स्पष्ट कीजिए। (2010, 12)
उत्तर
वेग स्थिरांक अभिकारक पदार्थों की इकाई सान्द्रता पर होने वाली अभिक्रिया की गति को कहते हैं। जबकि साम्य स्थिरांक उत्क्रमणीय अभिक्रिया में अग्र अभिक्रिया के वेग स्थिरांक तथा विपरीत क्रिया के साम्य स्थिरांक का अनुपात होता है।
प्रश्न 6.
तापीय गुणांक क्या है? अभिक्रिया के वेग से इसका सम्बन्ध बताइए। (2017)
उत्तर
तापीय गुणांक 10°C अन्तर के दो भिन्न तापों पर वेग स्थिरांकों के अनुपात के बराबर होता है।

यह प्राप्त मान 2 और 3 के मध्य में होता है।
प्रश्न 7.
निम्न अभिक्रिया की कोटि और वेग स्थिरांक की इकाई लिखिए – (2016)
H2 + Cl2 → 2HCl
उत्तर
अभिक्रिया की कोटि शून्य तथा वेग स्थिरांक की इकाई मोल लीटर-1 सेकण्ड-1।
प्रश्न 8.
कारण सहित बताइए कि निम्न में अभिक्रिया की कोटि क्या होगी? (2016)
2FeCl3 + SnCl2 → SnCl4 + 2FeCl2
उत्तर
अभिक्रिया तृतीय कोटि की है, क्योंकि तृतीय कोटि की अभिक्रिया में अभिकारक पदार्थ के तीन अणुओं का सान्द्रण समय के साथ-साथ परिवर्तित होता है अर्थात् इनका वेग अभिकारक के तीन अणुओं के सान्द्रण के रूप में व्यक्त होता है।
प्रश्न 9.
शून्य कोटि की अभिक्रिया से आप क्या समझते हैं? उदाहरण द्वारा समझाइए। इसके वेग स्थिरांक को व्यंजक लिखिए। (2012, 16)
या
कारण सहित बताइए कि निम्न रासायनिक अभिक्रिया किस कोटि की है?
![]()
उत्तर
शून्य कोटि की अभिक्रिया – वह अभिक्रिया जिसकी प्रगति में अभिकारक के किसी भी अणु का सान्द्रण परिवर्तित नहीं होता है अर्थात् जिसका वेग अभिकारक के सान्द्रण पर निर्भर नहीं करता है, शून्य कोटि की अभिक्रिया कहलाती है।
A → B+ C
यदि इसका वेग ∝[A]0 हो, तो यह शून्य कोटि की अभिक्रिया होगी।
उदाहरणार्थ- सूर्य के प्रकाश की उपस्थिति में H2 व Cl2 का संयोग
![]()
शून्य कोटि के वेग स्थिरांक का व्यंजक – शून्य कोटि की अभिक्रिया के वेग स्थिरांक का व्यंजक x = kt है।
जहाँ x अभिकारक A की वह मात्रा है जो t समय में अभिक्रिया करती है और है अभिक्रिया का वेग स्थिरांक है।
प्रश्न 10.
प्रथम कोटि की अभिक्रिया से आप क्या समझते हैं? उदाहरण द्वारा समझाइए। (2016)
या
प्रथम कोटि की अभिक्रिया के लक्षण लिखिए। (2011)
उत्तर
प्रथम कोटि की अभिक्रिया – वह अभिक्रिया जिसका वेग केवल एक अभिकारक की सान्द्रता के अनुक्रमानुपाती होता है, प्रथम कोटि की अभिक्रिया कहलाती है। उदाहरणार्थ-निम्नलिखित अभिक्रिया में केवल शक्कर के अणुओं की सान्द्रता परिवर्तित होती है; अत: यह प्रथम कोटि की अभिक्रिया है।
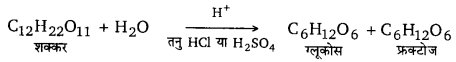
प्रथम कोटि की अभिक्रिया का समीकरण निम्नलिखित है –
[latex s=2]k=\frac { 2.303 }{ t } { log }_{ 10 }\frac { a }{ a-x } [/latex]
जहाँ a अभिकारक की प्रारम्भिक सान्द्रता तथा (a – x ) समय t पर सान्द्रता है।
लक्षण
- प्रथम कोटि की अभिक्रिया के वेग स्थिरांक ६ का मान अभिकारक की सान्द्रता की इकाई पर निर्भर नहीं करता। यह केवल समय की इकाई पर निर्भर करता है।
- इस अभिक्रिया के लिए log(a- x) और है के मध्य ग्राफ खींचने पर एक सरल रेखा प्राप्त होती है। जिसका ढाल [latex s=2]\frac { k }{ 2.303 } [/latex] है।
- प्रथम कोटि की अभिक्रिया का अर्द्ध-आयुकाल अभिकारकों के प्रारम्भिक सान्द्रण पर निर्भर नहीं करता
- अभिक्रिया के पूर्ण होने में अनन्त समय लगता है।
- अभिकारक की सान्द्रता n गुना बढ़ने पर अभिक्रिया का वेग भी n गुना बढ़ जाता है।
प्रश्न 11.
प्रथम कोटि की अभिक्रिया के वेग स्थिरांक की इकाई ज्ञात कीजिए। (2014)
उत्तर
प्रथम कोटि की अभिक्रिया का वेग समीकरण- r = k [A]1

प्रश्न 12.
एक प्रथम कोटि की अभिक्रिया का 50% (आधा भाग) 10 मिनट में समाप्त होता है। इस ” अभिक्रिया का 99% भाग कितने समय में पूरा होगा? (2012)
हल
प्रथम कोटि की वेग-अभिक्रिया का समीकरण

पुनः अभिक्रिया के 99% भाग पूरा होने में लगे समय के लिए अभिक्रिया के समीकरण से

अतः अभीष्ट समय 66.45 मिनट है।
प्रश्न 13.
एक यौगिक के 1 मोल से प्रारम्भ करने पर यह ज्ञात हुआ कि 1 घण्टे में अभिक्रिया तीन-चौथाई पूर्ण हो जाती है। वेग स्थिरांक की गणना कीजिए यदि अभिक्रिया प्रथम कोटि का अनुसरण करती है। (2016)
हल
प्रथम कोटि की अभिक्रिया के लिए,

प्रश्न 14.
एक प्रथम कोटि की अभिक्रिया 10 मिनट में 20% पूरी हो जाती है। अभिक्रिया के 75% पूरा होने में कितना समय लगेगा? (2016)
हल

प्रश्न 15.
एक प्रथम कोटि की अभिक्रिया के लिए अर्द्ध-आयु 69.3 सेकण्ड है। इस अभिक्रिया के लिए वेग स्थिरांक की गणना कीजिए। (2015)
हल
प्रथम कोटि की अभिक्रिया के लिए,
k= [latex s=2]\frac { 0.6932 }{ { t }_{ 1/2 } } =\frac { 0.6932 }{ 69.3 } [/latex] = 10-2 सेकण्ड-1
प्रश्न 16.
प्रथम कोटि की एक अभिक्रिया में 50 सेकण्ड में पदार्थ की सान्द्रता प्रारम्भिक सान्द्रता की आधी रह जाती है। इसके वेग स्थिरांक की गणना कीजिए। (20017, 18)
हल
प्रथम कोटि की अभिक्रिया के लिए,
[latex s=2]k=\frac { 0.6932 }{ { t }_{ 1/2 } } =\frac { 0.6932 }{ 50 } =\frac { 6.932 }{ 5 } [/latex] x 10-2
= 1.38 x 10-2 सेकण्ड-1
प्रश्न 17.
किसी प्रथम कोटि की अभिक्रिया का वेग स्थिरांक 7 x 10-4 प्रति सेकण्ड है। अपनी प्रारम्भिक सान्द्रता के 1/4 तक कम होने के लिए अभिकारक द्वारा लिए गए समय की गणना कीजिए। [log10 2= 0.3010] (2016)
हल
प्रथम कोटि की अभिक्रिया का वेग स्थिरांक

प्रश्न 18.
आरेनियस का समीकरण दीजिए। (2017)
उत्तर
k = Ae-Ea/RT ; जहाँ Ea सक्रियण ऊर्जा, R गैसीय स्थिरांक, T परमताप, k वेग स्थिरांक, A आवृत्ति गुणांक।
लघु उत्तरीय प्रश्न
प्रश्न 1.
अभिक्रिया की कोटि और आणविकता को समझाइए। (2009, 10, 12, 16, 17)
या
अभिक्रिया की कोटि को समझाते हुए निम्न अभिक्रिया की कोटि कारण सहित बताइए
C12H22O11 + H2O [latex s=2]\underrightarrow { { H }^{ + } } [/latex] C6H12O6 + C6H12O6 (2011, 17)
या
कारण सहित अभिक्रिया,
CH3COOC2H5 + NaOH [latex]\rightleftharpoons [/latex] CH3COONa + C2H5OH की कोटि बताइए। (2013)
उत्तर
आणविकता – किसी रासायनिक अभिक्रिया में भाग लेने वाले अभिकारक अणुओं की न्यूनतम संख्या को अभिक्रिया की आणविकता कहते हैं।
उदाहरणार्थ– (i) अमोनियम नाइट्राइट को गर्म करने पर होने वाली अभिक्रिया में अमोनियम नाइट्राइट का एक अणु भाग लेता है; अत: इसकी आणविकता एक है।
NH4NO2 → 2H2O + N2 ↑
(ii) NaOH द्वारा एथिल ऐसीटेट के जल – अपघटन की अभिक्रिया की आणविकता 2 है, क्योंकि इसमें दोनों अभिकारकों का एक-एक अणु भाग लेता है।
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
कोटि – किसी रासायनिक अभिक्रिया में भाग लेने वाले पदार्थों के अणुओं की वह संख्या जिनका सान्द्रण अभिक्रिया की प्रगति में परिवर्तित होता है, अभिक्रिया की कोटि कहलाती है।
उदाहरणार्थ– CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
उपर्युक्त अभिक्रिया में दोनों अभिकारकों के एक-एक अणु की सान्द्रता प्रभावित हो रही है; अत: यह द्वितीय कोटि की अभिक्रिया है परन्तु अभिक्रिया
C12H22O11 + H2O → C6H12O6 + C6H12O6 में केवल C12H22O11 की सान्द्रता में परिवर्तन होने पर अभिक्रिया का वेग परिवर्तित होता है। जल (H2O) की सान्द्रता में परिवर्तन का वेग पर कोई प्रभाव नहीं होता है। अतः अभिक्रिया की कोटि एक है।
प्रश्न 2.
आणविकता तथा कोटि में अन्तर स्पष्ट कीजिए। N,05 के अपघटन की कोटि निर्धारित कीजिए।
(2010, 12, 17, 18)
उत्तर
अभिक्रिया की आणविकता और कोटि में अन्तर
- अभिक्रिया की आणविकता सदैव एक पूर्ण संख्या होती है, जबकि अभिक्रिया की कोटि भिन्नात्मक भी हो सकती है।
- अभिक्रिया की आणविकता कभी-भी शून्य नहीं हो सकती, जबकि अभिक्रिया की कोटि शून्य भी हो सकती है।
- किसी अभिक्रिया की आणविकता और कोटि समान या भिन्न-भिन्न हो सकती हैं।
- अभिक्रिया के वेग निर्धारक पद में भाग लेने वाले अणुओं की संख्या उस पद की आणविकता कहलाती है। अभिक्रिया की कोटि उन अणुओं की संख्या है, जिनकी सान्द्रताएँ अभिक्रिया के वेग को निर्धारित करती हैं।
- अभिक्रियाको आणविकता की व्याख्या उसकी क्रिया-विधि द्वारा करते हैं, जबकि अभिक्रिया की कोटि प्रयोग द्वारा निकाली जाती है।
N2O5 के तापीय अपघटन की अभिक्रिया 2N2O5 → 4NO2 + O2 के लिए प्रयोगों द्वारा निर्धारित नियम निम्न है, दर = k [N2O5]
दर नियम में N2O5 की सान्द्रता की घात = 1 है, अत: N2O5 का अपघटन प्रथम कोटि की अभिक्रिया है।
प्रश्न 3.
प्रथम कोटि की अभिक्रिया के वेग स्थिरांक का सूत्र लिखिए। किसी अभिक्रिया में अभिकारक के सान्द्रण में 20 मिनट में 20% तथा 40 मिनट में 40% की कमी होती है। अभिक्रिया की कोटि की गणना कीजिए। (2015)
या
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक का व्यंजक लिखिए। (2017)
उत्तर
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक का सूत्र
[latex s=2]k=\frac { 2.303 }{ t } log\frac { a }{ a-x } [/latex]
जहाँ, k = वेग स्थिरांक, t = लगा समय, a = प्रारम्भिक मात्रा, a – x = बची हुई मात्रा कोटि की अभिक्रिया के लिए k = [latex s=2]\frac { x }{ t } [/latex]
- यदि t = 20% t = 20 मिनट, x = 20
k1 = [latex s=2]\frac { 20 }{ 20 } [/latex] = 1 मोल/लीटर/मिनट - यदि t = 40% t = 40 मिनट, x = 40
k2 = [latex s=2]\frac { 40 }{ 40 } [/latex] = 1 मोल/लीटर/मिनट
k1 तथा k2 बराबर हैं। अतः अभिक्रिया शून्य कोटि की होगी।
प्रश्न 4.
प्रथम कोटि की अभिक्रिया के वेग स्थिरांक के लिए व्यंजक लिखिए तथा सन्निहित पदों को समझाइए। दर्शाइए कि प्रथम कोटि की अभिक्रिया का अर्द्ध-आयुकाल अभिकारकों के प्रारम्भिक सान्द्रण पर निर्भर नहीं करता है। (2010, 12, 14, 17)
उत्तर
प्रथम कोटि की अभिक्रिया के लिए [latex s=2]k=\frac { 2.303 }{ t } { log }_{ 10 }\frac { a }{ a-x } [/latex]
जहाँ t = समय, a = अभिकारक का प्रारम्भिक सान्द्रण तथा (a – x), t समय बाद सान्द्रण है।
अभिक्रिया में आधा सान्द्रण समाप्त होने के लिए,
परिवर्तित सान्द्रण (x) = 0.5 a, t = t1/2 (अर्द्ध-आयुकाल)

उपर्युक्त समीकरण में सान्द्रण का कोई पद नहीं है; अतः प्रथम कोटि की अभिक्रिया का अर्द्ध-आयुकाल अभिकारक के प्रारम्भिक सान्द्रण पर निर्भर नहीं करता है।
प्रश्न 5.
सिद्ध कीजिए कि प्रथम कोटि की अभिक्रिया को 3/4 पूर्ण करने में लगा समय, अर्द्ध-क्रिया को पूर्ण करने में लगे समय का दोगुना होता है। (2015)
हल

प्रश्न 6.
प्रथम कोटि की एक अभिक्रिया में यदि कोई पदार्थ अपनी प्रारम्भिक मात्रा का 100 मिनट में आधा रह जाता है तो बताइए कि कितने समय में यह अपनी प्रारम्भिक मात्रा का एक-चौथाई रह जायेगा? (2017)
हल

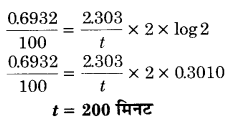
प्रश्न 7.
एक प्रथम कोटि की अभिक्रिया का अर्द्ध-आयुकाल 60 मिनट है। कितने समय में अभिक्रिया 90% पूर्ण हो जायेगी? (2015)
हल

प्रश्न 8.
एक प्रथम कोटि की अभिक्रिया का आधा भाग (50%) 10 मिनट में पूर्ण होता है। इस अभिक्रिया का 80% भाग कितने समय में पूर्ण होगा? (2017)
उत्तर

प्रश्न 9.
आभासी एकाणुक अभिक्रिया को उदाहरण द्वारा समझाइए। (2009, 11, 13, 15, 18)
उत्तर
वह अभिक्रिया जिसकी कोटि एक हो, परन्तु आणविकता एक न हो, आभासी एकाणुक क्रिया कहलाती है।
उदाहरणार्थ –
- C12H22O11 + H2O [latex]\underrightarrow { { H }^{ + } } [/latex] C6H12O6 + C6H12O6
- CH3COOCH3 + H2O [latex]\underrightarrow { { H }^{ + } } [/latex] CH3COOH + CH3OH
इन दोनों अभिक्रियाओं की कोटि एक है; क्योंकि H2O के सान्द्रण में कोई परिवर्तन नहीं होता, जबकि इनकी आणविकता दी है। अत: ये आभासी एकाणुक अभिक्रियाएँ हैं।
प्रश्न 10.
सक्रियण ऊर्जा क्या होती है? किसी अभिक्रिया का वेग सक्रियण ऊर्जा के मान को कैसे प्रभावित करता है? (2017)
उत्तर
ऊर्जा अवरोध को पार करके उत्पाद बनाने के लिए देहली ऊर्जा से कम ऊर्जा युक्त अभिकारक अणुओं को जितनी ऊर्जा की और आवश्यकता होती है उसे अभिक्रिया की सक्रियण ऊर्जा कहते हैं।
अत: सक्रियण ऊर्जा = देहली ऊर्जा – अभिकारक अणुओं की औसत ऊर्जा
या Ea = EThreshold – EReactants
प्रत्येक अभिक्रिया के लिए सक्रियण ऊर्जा का मान निश्चित होता है। किसी अभिक्रिया के लिए जब सक्रियण ऊर्जा का मान कम होता है तो अधिक संख्या में अणु ऊर्जा अवरोध को पार करके उत्पाद बना सकते हैं। इस प्रकार की अभिक्रियाओं के वेग अधिक होते हैं। सक्रियण ऊर्जा के उच्च मान युक्त अभिक्रियाओं के वेग कम होते हैं। अत: तीव्र अभिक्रियाओं के लिए सक्रियण ऊर्जा कम होती है। मन्द अभिक्रियाओं के लिए सक्रियण ऊर्जा अधिक होती है।
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
अभिक्रिया के वेग पर उत्प्रेरक की उपस्थिति का क्या प्रभाव पड़ता है? (2013)
उत्तर
उत्प्रेरक का प्रभाव (Effect of Catalyst) – उत्प्रेरक वह पदार्थ है जो स्वयं स्थायी रूप से परिवर्तित हुए बिना अभिक्रिया के वेग को परिवर्तित कर देता है। उदाहरणार्थ– MnO2 निम्नांकित अभिक्रिया को उत्प्रेरित कर वेग में महत्त्वपूर्ण वृद्धि करता है –
2KClO3 → 2KCl + 3O2

उत्प्रेरक की क्रिया को मध्यवर्ती संकुल सिद्धान्त से समझा जा सकता है। इस सिद्धान्त के अनुसार उत्प्रेरक रासायनिक अभिक्रिया में भाग लेकर अभिकारकों के साथ अस्थायी बन्ध बनाती है जो कि मध्यवर्ती संकुल में परिणत होता है। इसका अस्तित्व क्षणिक होता है तथा यह वियोजित होकर उत्पाद एवं उत्प्रेरक देता है। यह विश्वास किया जाता है कि उत्प्रेरक एक वैकल्पिक पथ अथवा क्रियाविधि से अभिकारकों वें उत्पादों के मध्य सक्रियण ऊर्जा कम करके एवं इस प्रकार ऊर्जा अवरोध में कमी करके अभिक्रिया सम्पन्न करता है जैसा कि चित्र-7 में दर्शाया गया है। आरेनिअस समीकरण से यह स्पष्ट है कि सक्रियण ऊर्जा का मान जितना कम होगा अभिक्रिया को वेग उतना अधिक होगा।
उत्प्रेरक की लघु मात्रा अभिकारकों की दीर्घ मात्रा को उत्प्रेरित कर सकती है। उत्प्रेरक, अभिक्रिया की गिब्ज ऊर्जा, ΔG, में बदलाव नहीं करता। यह स्वत:प्रवर्तित (spontaneous) अभिक्रियाओं को उत्प्रेरित करता है, परन्तु स्वत:अप्रवर्तित अभिक्रिया को उत्प्रेरित नहीं करता। यह भी पाया गया है कि उत्प्रेरक किसी अभिक्रिया के साम्य स्थिरांक में परिवर्तन नहीं करता, किन्तु यह साम्य को शीघ्र स्थापित करने में सहायता करता है। यह अग्र एवं प्रतीप दोनों अभिक्रियाओं को समान रूप से उत्प्रेरित करता है जिससे साम्यावस्था अपरिवर्तित रहती है, परन्तु शीघ्र स्थापित हो जाती हैं।
We hope the UP Board Solutions for Class 12 Chemistry Chapter 4 Chemical Kinetics (रासायनिक बलगतिकी) help you.