UP Board Solutions for Class 12 Physics Chapter 12 Atoms (परमाणु)
UP Board Solutions for Class 12 Physics Chapter 12 Atoms (परमाणु)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1:
प्रत्येक कथन के अन्त में दिए गए संकेतों में से सही विकल्प का चयन कीजिए
(a) टॉमसन मॉडल में परमाणु का साइज, रदरफोर्ड मॉडल में परमाण्वीय साइज से………..होता है। (अपेक्षाकृत काफी अधिक, भिन्न नहीं, अपेक्षाकृत काफी कम)
(b) ……..में निम्नतम अवस्था में इलेक्ट्रॉन स्थायी साम्य में होते हैं जबकि ……..में इलेक्ट्रॉन, सदैव नेट बल अनुभव करते हैं। (रदरफोर्ड मॉडल, टॉमसन मॉडल)
(c) ………पर आधारित किसी क्लासिकी परमाणु का नष्ट होना निश्चित है। (टॉमसन मॉडल, रदरफोर्ड मॉडल)
(d) किसी परमाणु के द्रव्यमान का……..में लगभग संतत वितरण होता है लेकिन……..में अत्यन्त असमान द्रव्यमान वितरण होता है। (रदरफोर्ड मॉडल, टॉमसन मॉडल)
(e) ………में परमाणु के धनावेशित भाग का द्रव्यमान सर्वाधिक होता है। (रदरफोर्ड मॉडल, दोनों मॉडलों)
उत्तर:
(a) भिन्न नहीं,
(b) टॉमसन, मॉडल, रदरफोर्ड मॉडल,
(c) रदरफोर्ड मॉडल,
(d) टॉमसन मॉडल, रदरफोर्ड मॉडल,
(e) रदरफोर्ड मॉडल।।
मान लीजिए कि स्वर्ण पन्नी के स्थान पर ठोस हाइड्रोजन की पतली शीट का उपयोग करके आपको ऐल्फा-कण प्रकीर्णन प्रयोग दोहराने का अवसर प्राप्त होता है। (हाइड्रोजन 14K से नीचे ताप पर ठोस हो जाती है।) आप किस परिणाम की अपेक्षा करते हैं?
उत्तर:
हाइड्रोजन परमाणु का नाभिक एक प्रोटॉन है जिसका द्रव्यमान (1.67 x 10-27 kg) α – कण के द्रव्यमान (6.64 x 10-27 kg) की तुलना में कम है। यह हल्का नाभिक भारी α -कण को प्रतिक्षिप्त नहीं कर पाएगा; अतः α-कण सीधे नाभिक की ओर जाने पर भी वापस नहीं लौटेगा और इस प्रयोग में α-कण का बड़े कोणों पर विक्षेपण भी नहीं होगा।
प्रश्न 3:
‘पाशन श्रेणी में विद्यमान स्पेक्ट्रमी रेखाओं की लघुतम तरंगदैर्ध्य क्या है?
उत्तर:

प्रश्न 4:
2.3eV ऊर्जा अन्तर किसी परमाणु में दो ऊर्जा स्तरों को पृथक कर देता है। उत्सर्जित विकिरण की आवृत्ति क्या होगी यदि परमाणु में इलेक्ट्रॉन उच्च स्तर से निम्न स्तर में संक्रमण करता है?
हल:
दिया है, ∆E = 2.3 eV= 2.3 x 1.6 x 10-19 जूल; h = 6.62 x 10-34 जूल-सेकण्ड विकिरण की आवृत्ति ν = ?

प्रश्न 5:
हाइड्रोजन परमाणु की निम्नतम अवस्था में ऊर्जा -13.6 eV है। इस अवस्था में इलेक्ट्रॉन की गतिज ऊर्जा और स्थितिज ऊर्जाएँ क्या होंगी?
हल:
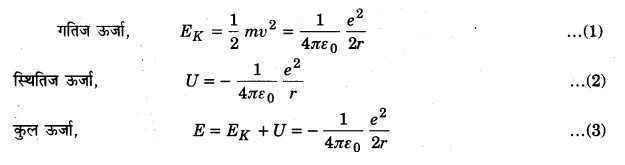
प्रश्न 6:
निम्नतम अवस्था में विद्यमान एक हाइड्रोजन परमाणु एक फोटॉन को अवशोषित करता है। जो इसे n = 4 स्तर तक उत्तेजित कर देता है। फोटॉन की तरंगदैर्घ्य तथा आवृत्ति ज्ञात कीजिए।
हल:

प्रश्न 7:
(a) बोर मॉडल का उपयोग करके किसी हाइड्रोजन परमाणु में n=1, 2 तथा 3 स्तरों पर इलेक्ट्रॉन की चाल परिकलित कीजिए।
(b) इनमें से प्रत्येक स्तर के लिए कक्षीय अवधि परिकलित कीजिए।
हल:
(a) दिया है,
e= 1.6 x 10-19 कूलॉम, ६ = 8.85 x 10-12 कूलॉम2/न्यूटन मीटर2
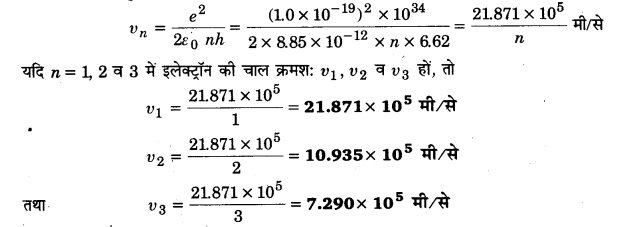

प्रश्न 8:
हाइड्रोजन परमाणु में अन्तरतम इलेक्ट्रॉन-कक्षा की त्रिज्या 5.3 x 10-11m है। कक्षा n= 2 और n = 3 की त्रिज्याएँ क्या हैं?
हल:
बोर की nवीं कक्षा की त्रिज्या

प्रश्न 9:
कमरे के ताप पर गैसीय हाइड्रोजन पर किसी 12.5 eV की इलेक्ट्रॉन पुंज की बमबारी की गई। किन तरंगदैघ्र्यों की श्रेणी उत्सर्जित होगी?
हल:
निम्नतम ऊर्जा स्तर में H2 परमाणु की ऊर्जा E1 = -13.6 eV
जब इस पर 12.5eV ऊर्जा के इलेक्ट्रॉन की बमबारी की जाती है तो इस ऊर्जा को अवशोषित करने पर माना यह नावे उत्तेजित ऊर्जा स्तर में चला जाता है।
अत: En = E1 +12.75 = -(-13.6 +12.75)eV = -0.85 eV
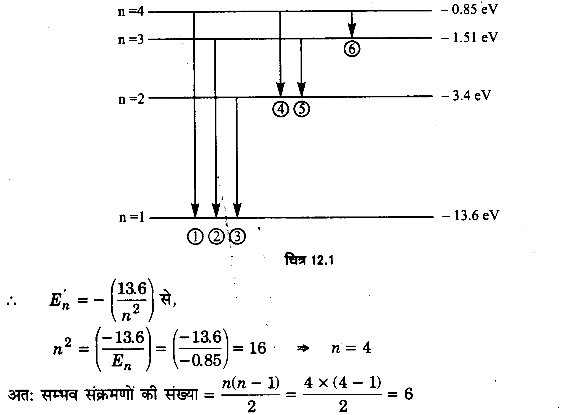
अत: चित्र 12.1 में प्रदर्शित रेखाएँ (तरंगदैर्घ्य उत्सर्जित होंगी)।
सूत्र λ = से, प्रत्येक रेखा के संगत तरंगदैर्घ्य ज्ञात करें। इनके मान क्रमशः होंगे
970.6 , 1023.6
; 1213.2
, 4852.9
; 6547.6
; 28409
प्रश्न 10:
बोर मॉडल के अनुसार सूर्य के चारों ओर 1.5 x 1011m त्रिज्या की कक्षा में, 3 x 104m/s के कक्षीय वेग से परिक्रमा करती पृथ्वी की अभिलाक्षणिक क्वांटम संख्या ज्ञात कीजिए। (पृथ्वी का द्रव्यमान= 6.0 x 1024 kg)।
हल:
दिया है, पृथ्वी का द्रव्यमान m = 6.0 x 1024 किग्रा; कक्षा की त्रिज्या r = 1.5 x 1011 मीटर
तथा पृथ्वी का कक्षीय वेग ν = 3 x 104 मीटर/सेकण्ड
h = 6.62 x 104 जूल-सेकण्ड
बोर मॉडल के अनुसार, mνr =
27 यहाँ n कक्षा की अभिलाक्षणिक क्वाण्टम संख्या है।
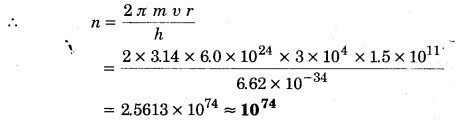
उपग्रह की गति के लिए यह क्वाण्टम संख्या अत्यन्त विशाल है और इतनी विशाल क्वाण्टम संख्या के लिए क्वाण्टीकृत प्रतिबन्धों के परिणाम चिरसम्मत भौतिकी से मेल खाने लगते हैं।
अतिरिक्त अभ्यास
प्रश्न 11:
निम्नलिखित प्रश्नों के उत्तर दीजिए जो आपको टॉमसन मॉडल और रदरफोर्ड मॉडल में अन्तर समझने हेतु अच्छी तरह से सहायक हैं।
(a) क्या टॉमसन मॉडल में पतले स्वर्ण पन्नी से प्रकीर्णित α-कणों का पूर्वानुमानित औसत विक्षेपण कोण, रदरफोर्ड मॉडल द्वारा पूर्वानुमानित मान से अत्यन्त कम, लगभग समान अथवा अत्यधिक बड़ा है?
(b) टॉमसन मॉडल द्वारा पूर्वानुमानित पश्च प्रकीर्णन की प्रायिकता (अर्थात α-कणों का 90° से बड़े कोणों पर प्रकीर्णन) रदरफोर्ड मॉडल द्वारा पूर्वानुमानित मान से अत्यन्त कम, लगभग समान अथवा अत्यधिक है?
(c) अन्य कारकों को नियत रखते हुए, प्रयोग द्वारा यह पाया गया है कि कम मोटाई t के लिए, मध्यम कोणों पर प्रकीर्णित α-कणों की संख्या t के अनुक्रमानुपातिक है। t पर यह रैखिक निर्भरता क्या संकेत देती है?
(d) किस मॉडल में α -कणों के पतली पन्नी से प्रकीर्णन के पश्चात औसत प्रकीर्णन कोण के परिकलन हेतु बहुप्रकीर्णन की उपेक्षा करना पूर्णतया गलत है?
उत्तर:
(a) औसत विक्षेपण कोण दोनों मॉडलों के लिए लगभग समान है।
(b) टॉमसन मॉडल द्वारा पूर्वानुमानित पश्च प्रकीर्णन की प्रायिकता, रदरफोर्ड मॉडल द्वारा पूर्वानुमानित मान की तुलना में अत्यन्त कम है।
(c) t पर रैखिक निर्भरता यह प्रदर्शित करती है कि प्रकीर्णन मुख्यतः एकल संघट्ट के कारण होता है। मोटाई t के बढ़ने के साथ लक्ष्य स्वर्ण नाभिकों की संख्या रैखिक रूप से बढ़ती है; अत: α-कणों के, स्वर्ण नाभिक से एकल संघट्ट की सम्भावना रैखिक रूप से बढ़ती है।
(d) टॉमसन मॉडल में परमाणु का सम्पूर्ण धनावेश परमाणु में समान रूप से वितरित है; अत: एकल संघट्ट α-कण को अल्प कोण से विक्षेपित कर पाता है। अतः इस मॉडल में औसत प्रकीर्णन कोण का परिकलन, बहुप्रकीर्णन के आधार पर ही किया जा सकता है। दूसरी ओर रदरफोर्ड मॉडल में प्रकीर्णन एकल संघट्ट के कारण होता है; अतः बहुप्रकीर्णन की उपेक्षा की जा सकती है।
प्रश्न 12:
हाइड्रोजन परमाणु में इलेक्ट्रॉन एवं प्रोटॉन के मध्य गुरुत्वाकर्षण, कूलॉम-आकर्षण से लगभग 10-40 के गुणक से कम है। इस तथ्य को देखने का एक वैकल्पिक उपाय यह है कि यदि इलेक्ट्रॉन एवं प्रोटॉन गुरुत्वाकर्षण द्वारा सम्बद्ध हों तो किसी हाइड्रोजन परमाणु में प्रथम बोर कक्षा की त्रिज्या का अनुमान लगाइए। आप मनोरंजक उत्तर पाएँगे।
हल:
माना इलेक्ट्रॉन का द्रव्यमान me व प्रोटॉन का द्रव्यमान mp है।

जहाँ rn, nवीं कक्षा की त्रिज्या है।
यह बल इलेक्ट्रॉन को आवश्यक अभिकेन्द्र बल देता है।

प्रश्न 13:
जब कोई हाइड्रोजन परमाणु स्तर n से स्तर (n-1) पर व्युत्तेजित होता है तो उत्सर्जित विकिरण की आवृत्ति हेतु व्यंजक प्राप्त कीजिए।n के अधिक मान हेतु, दर्शाइए कि यह आवृत्ति, इलेक्ट्रॉन की कक्षा में परिक्रमण की क्लासिकी आवृत्ति के बराबर है।
हल:
n वें ऊर्जा स्तर में हाइड्रोजन परमाणु की ऊर्जा निम्नलिखित है


अत: समीकरण (4) एवं (5) से स्पष्ट है कि के उच्च मानों हेतु 7वीं कक्षा में इलेक्ट्रॉन की क्लासिकी घूर्णन आवृत्ति, हाइड्रोजन परमाणु द्वारा n वें ऊर्जा स्तर से (n-1) वें ऊर्जा स्तर में जाने के दौरान उत्सर्जित विकिरण की आवृत्ति के बराबर होती है।
प्रश्न 14:
क्लासिकी रूप में किसी परमाणु में इलेक्ट्रॉन नाभिक के चारों ओर किसी भी कक्षा में हो सकता है। तब प्रारूपी परमाण्वीय साइज किससे निर्धारित होता है? परमाणु अपने प्रारूपी साइज की अपेक्षा दस हजार गुना बड़ा क्यों नहीं है? इस प्रश्न ने बोर को अपने प्रसिद्ध परमाणु मॉडल, जो आपने पाठ्यपुस्तक में पढ़ा है, तक पहुँचने से पहले बहुत उलझन में डाला था। अपनी खोज से पूर्व उन्होंने क्या किया होगा, इसको अनुकरण करने के लिए हम मूल नियतांकों की प्रकृति के साथ निम्न गतिविधि करके देखें कि क्या हमें लम्बाई की विमा वाली कोई राशि प्राप्त होती है, जिसका साइज, लगभग परमाणु के ज्ञांत साइज (~10-10m) के बराबर है।।
(a) मूल नियतांकों e, me और c से लम्बाई की विमा वाली राशि की रचना कीजिए। उसका संख्यात्मक मान भी निर्धारित कीजिए।
(b) आप पाएँगे कि (a) में प्राप्त लम्बाई परमाण्वीय विमाओं के परिमाण की कोटि से काफी छोटी है। इसके अतिरिक्त इसमें सम्मिलित है। परन्तु परमाणुओं की ऊर्जा अधिकतर अनापेक्षिकीय क्षेत्र (non: relativistic domain) में है जहाँ c की कोई अपेक्षित भूमिका नहीं है। इसी तर्क ने बोर को c का परित्याग कर सही परमाण्वीय साइज को प्राप्त करने के लिए कुछ अन्य देखने के लिए प्रेरित किया। इस समय प्लांक नियतांक h का कहीं और पहले ही आविर्भाव हो चुका था। बोर की सूक्ष्मदृष्टि ने पहचाना कि h, me और e के प्रयोग से ही सही परमाणु साइज प्राप्त होगा। अतः h, me और e से ही लम्बाई की विमा वाली किसी राशि की रचना कीजिए और पुष्टि कीजिए कि इसका संख्यात्मक मान वास्तव
में सही परिमाण की कोटि का है।
हल:
(a) दी गई राशियों के विमीय सूत्र निम्नलिखित हैं



प्रश्न 15:
हाइड्रोजन परमाणु की प्रथम उत्तेजित अवस्था में इलेक्ट्रॉन की कुल ऊर्जा लगभग – 3.4eV है।
(a) इस अवस्था में इलेक्ट्रॉन की गतिज ऊर्जा क्या है?
(b) इस अवस्था में इलेक्ट्रॉन की स्थितिज ऊर्जा क्या है?
(c) यदि स्थितिज ऊर्जा के शून्य स्तर के चयन में परिवर्तन कर दिया जाए तो ऊपर दिए गए उत्तरों में से कौन-सा उत्तर परिवर्तित होगा?
हल:
(a) माना प्रथम उत्तेजित अवस्था में कक्षा की त्रिज्या r है।
∵ इलेक्ट्रॉन को अभिकेन्द्र बल, स्थिर विद्युत बल से मिलता है; अतः

(b) स्थितिज ऊर्जा U = – 2K
⇒ U = – 6.8 eV
(c) यदि स्थितिज ऊर्जा के शून्य को बदल दिया जाए तो इलेक्ट्रॉन की स्थितिज ऊर्जा तथा कुल ऊर्जा बदल जाएगी जबकि गतिज ऊर्जा अपरिवर्तित रहेगी।
प्रश्न 16:
यदि बोर का क्वांटमीकरण अभिगृहीत ( कोणीय संवेग ) प्रकृति का मूल नियम है तो यह ग्रहीय गति की दशा में भी लागू होना चाहिए। तब हम सूर्य के चारों ओर ग्रहों की कक्षाओं के क्वांटमीकरण के विषय में कभी चर्चा क्यों नहीं करते?
हल:
माना हम बोर के क्वांटम सिद्धान्त को पृथ्वी की गति पर लागू करते हैं। इसके अनुसार
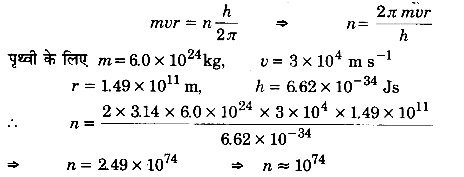
∴ n का मान बहुत अधिक है; अत: इसका यह अर्थ हुआ कि ग्रहों की गति से सम्बद्ध कोणीय संवेग तथा ऊर्जा की तुलना में अत्यन्त बड़ी हैं। n के इतने उच्च मान के लिए, किसी ग्रह के बोर मॉडल के दो क्रमागत क्वांटमीकृत ऊर्जा स्तरों के बीच ग्रह के कोणीय संवेग तथा ऊर्जाओं के अन्तर किसी ऊर्जा स्तर में ग्रह के कोणीय संवेग तथा ऊर्जा की तुलना में नगण्य हैं, इसी कारण ग्रहों की गति में ऊर्जा स्तर क्वांटमीकृत होने के स्थान पर सतत प्रतीत होते हैं।
प्रश्न 17:
प्रथम बोर-त्रिज्या और म्यूओनिक हाइड्रोजन परमाणु [अर्थात् कोई परमाणु जिसमें लगभग 207 me द्रव्यमान का ऋणावेशित म्यूऑन(μ–) प्रोटॉन के चारों ओर घूमता है। की निम्नतम अवस्था ऊर्जा को प्राप्त करने का परिकलन कीजिए।
हल:
एक म्यूओनिक हाइड्रोजन परमाणु में प्रोटॉन रूपी नाभिक के चारों ओर एक म्यूऑन (आवेश = – 1.6 x 10-19C, द्रव्यमान mμ = 207me
वृत्तीय कक्षा में चक्कर लगाता है।

परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1:
हाइड्रोजन परमाणु की भूतल (आद्य) अवस्था में ऊर्जा – 13.6 इलेक्ट्रॉन-वोल्ट है। n = 3ऊर्जा स्तर में इसकी ऊर्जा होगी (2014)
(i) -1.51 eV
(ii) – 3.20 eV
(iii)- 0.51 eV
(iv) 40.80 eV
उत्तर:
(i) -1.51 eV
प्रश्न 2:
एक हाइड्रोजन परमाणु को आयनित करने के लिए आवश्यक न्यूनतम ऊर्जा है
या
हाइड्रोजन परमाणु की आयनन ऊर्जा है (2015, 18)
(i) 13.6 ey से अधिक
(ii) 13.6 eV
(iii) 10.2 eV
(iv) 3.4 eV
उत्तर:
(ii) 13.6 eV
प्रश्न 3:
किसी हाइड्रोजन परमाणु का इलेक्ट्रॉन उत्तेजित अवस्था, n = 5 में है। इससे उत्सर्जित होने वाले विकिरण में सम्भव आवृत्तियों की कुल संख्या होगी (2009)
(i) 4
(ii) 5
(iii) 10
(iv) 25
उत्तर:
(iii) 10
प्रश्न 4:
हाइड्रोजन परमाणु की द्वितीय कक्षा से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा होगी (हाइड्रोजन परमाणु का आयनीकरण विभव = 13.6V) (2009)
(i) 13.6 eV
(ii) 6.3 eV
(iii) 3.4 ev
(iv) 2.4 eV
उत्तर:
(iii) 3.4 ev
प्रश्न 5:
हाइड्रोजन परमाणु में इलेक्ट्रॉन की प्रथम कक्षा की त्रिज्या 0.53Å है। इसकी तीसरी कक्षा की त्रिज्या होगी (2012)
(i) 4.77
(ii) 1.69
(iii) 1.06
(iv) 1.0
उत्तर:
(i) 4.77
प्रश्न 6:
हाइड्रोजन परमाणु के भूतलऊर्जा-स्तर में इलेक्ट्रॉन का कोणीय संवेग है (2010, 17)
(i) h/π
(ii) h/ 2π
(iii)
(iv) π/h
उत्तर:
(ii) h/ 2π
प्रश्न 7:
हाइड्रोजन परमाणु में त्रिज्या की कक्षा में इलेक्ट्रॉन की गतिज ऊर्जा है (2011)

उत्तर:

प्रश्न 8:
चार ऊर्जा स्तरों के बीच संक्रमण से उत्सर्जित स्पेक्ट्रमी रेखाओं की संख्या होगी (2011)
(i) 10
(ii) 8
(iii) 6
(iv)3
उत्तर:
(iii) 6
प्रश्न 9:
हाइड्रोजन की लाइमन श्रेणी की प्रथम रेखा की तरंगदैर्घ्य है (2009)
(i) 912
(ii) 1125
(iii) 1215
(iv) 1152
उत्तर:
(iii) 1215
अतिलघु उत्तरीय प्रश्न
प्रश्न 1:
परमाणु में इलेक्ट्रॉन की स्थायी कक्षा किसे कहते हैं तथा उसकी शर्त क्या होती है? (2012)
उत्तर:
कुछ निश्चित त्रिज्याओं की कक्षाएँ जिनमें घूमता इलेक्ट्रॉन ऊर्जा का उत्सर्जन नहीं करता है, स्थायी कक्षाएँ कहलाती हैं। इन कक्षाओं में घूमते इलेक्ट्रॉन का कोणीय संवेग h/2π का पूर्ण गुणक होता है। अर्थात्
mνr= nh/2π (जहाँ, n = 1, 2, 3, …)
प्रश्न 2:
परमाणु में इलेक्ट्रॉन की स्थायी कक्षा की विशेषताओं का उल्लेख कीजिए। (2015)
उत्तर:
इलेक्ट्रॉन की स्थायी कक्षा वह होती है जिसमें घूमते हुए इलेक्ट्रॉन ऊर्जा उत्सर्जित नहीं करता। इन कक्षाओं में घूमते इलेक्ट्रॉन का कोणीय संवेग, h/2π को पूर्ण गुणज होता है, जहाँ h प्लांक नियतांक है। इसे क्वाण्टम प्रतिबन्ध कहते हैं।
प्रश्न 3:
किसी परमाणु के उत्तेजन विभव से क्या तात्पर्य है? (2013)
उत्तर:
वह न्यूनतम त्वरक विभव जो किसी इलेक्ट्रॉन को इतनी ऊर्जा प्रदान कर सके कि वह किसी परमाणु से टकराने पर उसे निम्नतम ऊर्जा-स्तर से ठीक आगे वाले ऊर्जा-स्तर में उत्तेजित कर सके, परमाणु का प्रथम उत्तेजन विभव कहलाता है।
प्रश्न 4:
आयनन ऊर्जा की परिभाषा दीजिए। हाइड्रोजन परमाणु के लिए इसका मान क्या है? (2016)
उत्तर:
यदि किसी परमाणु को निम्नतम अथवा मूल अवस्था में +13.6eV ऊर्जा बाहर से दी जाए तो परमाणु की कुल ऊर्जा = -13.6eV +13.6 eV = 0 हो जाएगी अर्थात् परमाणु आयनित अवस्था में पहुँच जाएगा। यह बाह्य ऊर्जा ही परमाणु की आयनन ऊर्जा कहलाती है। हाइड्रोजन परमाणु के लिए इसका मान 13.6 eV होगा।
प्रश्न 5:
हाइड्रोजन परमाणु की आयनन ऊर्जा ज्ञात कीजिए। (2015)
हल:
![]()
अतः आयनित अवस्था (n = ∞] में ऊर्जा E∞= 0
परमाणु की निम्नतम अवस्था (n= 1) में ऊर्जा E1 = – 13.6 eV
अत: यदि परमाणु को निम्नतम अथवा मूल अवस्था में 13.6 eV ऊर्जा बाहर से दी जाये, तो परमाणु की कुल ऊर्जा =- 13.6 eV+ 13.6 eV = 0 हो जायेगी अर्थात् परमाणु आयनित अवस्था में पहुँच जायेगा।।
प्रश्न 6:
रिडबर्ग नियतांक का मान लिखिए। (2011)
उत्तर:
1.097 x 107 मीटर-1
प्रश्न 7:
हाइड्रोजन परमाणु की आयनन ऊर्जा 13.6 eV है। हीलियम परमाणु की आयनन ऊर्जा कितनी होगी? (2013)
हल:
Z परमाणु क्रमांक वाले हाइड्रोजन सदृश परमाणु की n वीं बोहर कक्षा की आयनन ऊर्जा
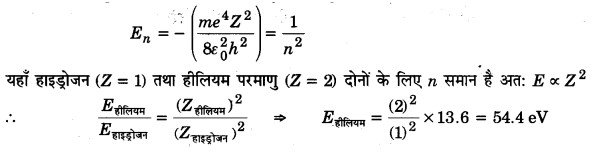
प्रश्न 8:
किसी उत्तेजित हाइड्रोजन परमाणु के इलेक्ट्रॉन की ऊर्जा-3.4eV है। इस इलेक्ट्रॉन का कोणीय संवेग ज्ञात कीजिए। (2012)
हल:

प्रश्न 9:
हाइड्रोजन के प्रथम बोर कक्षा की त्रिज्या 0.5है। तृतीय बोर कक्षा की त्रिज्या ज्ञात कीजिए। (2017)
हल:
दिया है, n1= 1, n3 = 3, r1 = 0.5 , r3 = ?
बोर के nवीं कक्षा की त्रिज्या rn α n2 से

प्रश्न 10:
हाइड्रोजन परमाणु के वर्णक्रम में बॉमर श्रेणी की प्रथम रेखा की तरंगदैर्घ्य की गणना कीजिए। (2017)
उत्तर:
6563
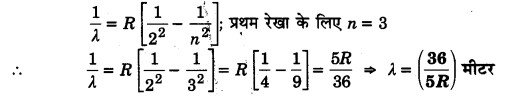
प्रश्न 11:
हाइड्रोजन पर है बॉमर श्रेणी की प्रथम रेखा की तरंगदैर्ध्य रिडबर्ग नियतांक के पदों में बताइए। (2010)
हल:
प्रश्न 12:
हाइड्रोजन के स्पेक्ट्रम में प्राप्त होने वाली कुछ स्पेक्ट्रमी रेखाओं की तरंगदैर्घ्य नीचे दी गई हैं। निम्न में से लाइमन श्रेणी की तरंगदैर्घ्य चुनिए
6560 , 1216
, 9546
, 4860
, 1026
: (2012)
हल:
1216 , 1026
.
प्रश्न 13:
हाइड्रोजन परमाणु की बॉमर श्रेणी की रेखाओं की आवृत्ति के लिए सूत्र लिखिए। (2014)
उत्तर:

प्रश्न 14:
हाइड्रोजन स्पेक्ट्रम में बॉमर श्रेणी की द्वितीय रेखा की तरंगदैर्घ्य रिडबर्ग नियतांक R के पदों में लिखिए। (2015)
हल:
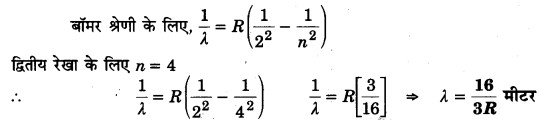
लघु उत्तरीय प्रश्न
प्रश्न 1:
हाइड्रोजन परमाणु के लिए बोर की परिकल्पनाएँ लिखिए। (2014, 16, 17)
या
हाइड्रोजन परमाणु के लिए बोर की अभिधारणाएँ लिखिए। हाइड्रोजन परमाणु की प्रथम कक्षा की त्रिज्या के लिए व्यंजक निगमित कीजिए। (2015)
या
बोर के परमाणविक मॉडल के अभिगृहीतों का उल्लेख कीजिए। इसके आधार पर इलेक्ट्रॉन की nवीं कक्षा की त्रिज्या के लिए व्यंजक प्राप्त कीजिए। (2017)
उत्तर:
रदरफोर्ड के परमाणु मॉडल की कमियों को नील बोर ने प्लांक के क्वाण्टम सिद्धान्त के आधार पर सन् 1913 में दूर किया। इसके लिए उन्होंने निम्नलिखित तीन नये अभिगृहीत (postulate) प्रस्तुत किये
बोर की परिकल्पनाएँ।
(i) इलेक्ट्रॉन नाभिक के चारों ओर केवल उन्हीं कक्षाओं में घूम सकते हैं जिनके लिए उनका कोणीय संवेग h/2π का पूर्ण गुणज हो,
अर्थात् Iω = mrnνn) = nh/2π
जहाँ I इलेक्ट्रॉन की nवीं कक्षा में जड़त्व-आघूर्ण तथा ω कोणीय वेग है। पूर्णांक n = 1, 2, 3, … तथा h प्लांक नियतांक है। इस प्रकार बोर ने माना कि इलेक्ट्रॉन नाभिक के चारों ओर कुछ निश्चित त्रिज्या की कक्षाओं में ही घूम सकते हैं। इन कक्षाओं को स्थायी कक्षाएँ (stationary orbits) कहते हैं।
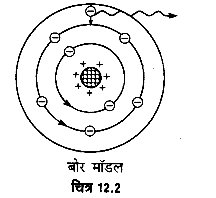
(ii) स्थायी कक्षाओं में घूमते समय इलेक्ट्रॉन ऊर्जा का उत्सर्जन नहीं करते। अतः परमाणु का स्थायित्व बना रहता है।।
(iii) जब परमाणु को बाहर से ऊर्जा मिलती है तो उसका कोई इलेक्ट्रॉन उसे ग्रहण कर ऊँची कक्षा में चला जाता है। यह परमाणु की उत्तेजित अवस्था कहलाती है। इलेक्ट्रॉन ऊँची कक्षा में केवल 10-8 सेकण्ड तक ठहर कर तुरन्त वापस किसी भी नीची कक्षा में लौट आता है और लौटते समय दोनों कक्षाओं की ऊर्जा के अन्तर के बराबर ऊर्जा वैद्युत-चुम्बकीय तरंगों के रूप में उत्सर्जित करता है। यदि उत्सर्जित तरंगों की आवृत्ति ν हो तथा इलेक्ट्रॉन की उच्च कक्षा में ऊर्जा E2 तथा नीची कक्षा में ऊर्जा E1 हों, तो ,

अत: ऊर्जा का उत्सर्जन केवल तभी तक होता है जब तक कि कोई इलेक्ट्रॉन किसी निश्चित ऊँची कक्षा से नीची कक्षा में लौटता है। इस प्रकार परमाणु से केवल कुछ निश्चित आवृत्तियों (तरंगदैर्घ्य) की तरंगें उत्सर्जित होती हैं जो रेखीय स्पेक्ट्रम देती हैं।
इस प्रकार परमाणु के बोर मॉडल के आधार पर हाइड्रोजन के स्पेक्ट्रम की व्याख्या की गई।
हाइड्रोजन परमाणु की प्रथम कक्षा की त्रिज्या के लिए व्यंजक:
हाइड्रोजन-सदृश परमाणु में एकल इलेक्ट्रॉन परमाणु के इलेक्ट्रॉन नाभिक के चारों ओर एक स्थायी कक्षा में घूमता है। माना कि e, m वे ν इलेक्ट्रॉन के क्रमश: आवेश, द्रव्यमान व वेग हैं तथा कक्षा की त्रिज्या है। (हाइड्रोजन नाभिक पर धनावेश Ze है, जहाँ,Z परमाणु-क्रमांक है (हाइड्रोजन परमाणु के लिए Z = 1)। इलेक्ट्रॉन को अपनी कक्षा में घूमने के लिए आवश्यक अभिकेन्द्र बल, नाभिक व इलेक्ट्रॉन के बीच स्थिर वैद्युत
आकर्षण-बल से प्राप्त होता है। अतः


प्रश्न 2:
हाइड्रोजन परमाणु की मूल अवस्था में इलेक्ट्रॉन की ऊर्जा- 13.6 eV है। इसे 13.6 eV ऊर्जा दी जाती है। यह किस ऊर्जा स्तर में पहुँचेगा? इस प्रक्रिया में अवशोषित फोटॉन की | तरंगदैर्घ्य कितनी होगी ? (2010)
हल:

प्रश्न 3:
सोडियम परमाणु का प्रथम उत्तेजन विभव 2.1 वोल्ट है। इस परमाणु द्वारा उत्सर्जित प्रकाश की तरंगदैर्घ्य ज्ञात कीजिए। (2012)
हल:
परमाणु का प्रथम उत्तेजन-विभव 2.1 वोल्ट है। इसका अर्थ यह है कि परमाणु निम्नतम ऊर्जा-स्तर, से अगले ऊर्जा-स्तर में जाने के लिए 2.1 इलेक्ट्रॉन वोल्ट (eV) ऊर्जा लेता है। यदि इस ऊर्जा-स्तर से वापस निम्नतम ऊर्जा-स्तर में लौटते समय परमाणु द्वारा उत्सर्जित प्रकाश की तरंगदैर्घ्य λ( आवृत्ति ν ) हो, तो :
क्वाण्टम के सिद्धान्त के अनुसार,
∆E = hν = hc/λ
जहाँ, ∆E इन दो ऊर्जा-स्तरों को अन्तर है।

प्रश्न 4:
संतत (अविरत) स्पेक्ट्रम व रेखीय स्पेक्ट्रम में अन्तर बताइए। (2013)
उत्तर:
रेखीय स्पेक्ट्रम:
इस प्रकार के स्पेक्ट्रम में काली पृष्ठभूमि पर केवल कुछ चमकीली रंगीन रेखाएँ प्राप्त होती हैं। इन्हें स्पेक्ट्रमी रेखाएँ (spectrum lines) कहते हैं, जिनकी संख्या तथा तरंगदैर्घ्य केवल लिये गए तत्त्व (element) पर निर्भर करती है, किसी अन्य राशि पर नहीं।
अविरत या संतत स्पेक्ट्रम:
इस स्पेक्ट्रम में लाल रंग से लेकर बैंगनी तक सभी रंगों की सभी तरंगदैर्ध्य विद्यमान रहती हैं। इसमें सभी रंग एक सिरे से दूसरे सिरे तक एक बिना टूटी हुई पट्टी के रूप में उपस्थित रहते हैं, अर्थात् इन स्पेक्ट्रमों में यह बताना कठिन है कि एक रंग कहाँ समाप्त हो रहा है। और दूसरा रंग कहाँ से आरम्भ हो रहा है। पास-पास के रंग एक-दूसरे में इस प्रकार विलीन रहते हैं कि दो रंगों के बीच कोई निश्चित पृथक्कारी रेखा (line of separation) नहीं होती।
प्रश्न 5:
बॉमर श्रेणी की द्वितीय रेखा की तरंगदैर्घ्य 4860Å है। ज्ञात कीजिए
(i) रिडबर्ग नियतांक
(ii) बॉमर श्रेणी की प्रथम रेखा की तरंगदैर्घ्य (2017)
हल:

प्रश्न 6:
बॉमर श्रेणी की प्रथम रेखा की तरंगदैर्ध्य 6563Å है। इस श्रेणी की दूसरी रेखा की तरंगदैर्घ्य ज्ञात कीजिए। (2013)
हल:


दीर्घ उत्तरीय प्रश्न
प्रश्न 1:
रदरफोर्ड के परमाणु मॉडल की व्याख्या कीजिए तथा इसकी कमियों का उल्लेख कीजिए। (2015)
उत्तर:
परमाणु की सही संरचना जानने के लिये रदरफोर्ड ने सन् स्वर्ण-पत्र 1911 में एक महत्त्वपूर्ण प्रयोग किया जिसे चित्र 12.4 में दिखाया प्रस्फुर गया है। इसमें रेडियोऐक्टिव तत्त्व पोलोनियम (polonium) से गणित्र उच्च गतिज ऊर्जा से निकलने वाली α-कणों के एक बारीक किरण-पुंज को एक बहुत पतले स्वर्ण-पत्र पर गिराया गया। पूरे प्रबन्ध को निर्वात् में रखा गया जिससे α -कणों की वायु के कणों से कोई टक्कर न हो। रदरफोर्ड ने यह देखा कि स्वर्ण-पत्र में से गुजरते हुए ये कण विभिन्न दिशाओं में विक्षेपित हो जाते हैं।
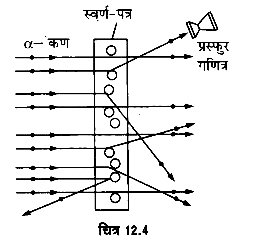
ऐल्फा α-कणों के अपने मार्ग से विक्षेपित होने की इस घटना को , ‘प्रकीर्णन’ कहते हैं। स्वर्ण-पत्र से विभिन्न दिशाओं में निकलने वाले कणों को एक प्रस्फुर गणित्र (scintillation counter) द्वारा गिन सकते हैं। रदरफोर्ड ने इस प्रयोग से निम्नलिखित महत्त्वपूर्ण तथ्य प्राप्त किये
- अधिकांश α-कण स्वर्ण-फ्त्र के आर-पार बिना प्रभावित हुए सीधे ही निकल जाते हैं। इससे रदरफोर्ड ने यह निष्कर्ष निकाला कि परमाणु का अधिकांश भाग भीतर से खोखला होता है।
(यह किसी भी दशा में ठोस नहीं हो सकता जैसा कि टॉमसन ने माना था)। - कुछ α-कण छोटे-छोटे कोण बनाते हुए विक्षेपित हो जाते हैं, तथा इनका कोणीय वितरण
सुनिश्चित होता है। अब, , चूँकि α-कण धनावेशित हैं, अतः इन्हें विक्षेपित करने वाला परमाणु भी धनावेशित होना चाहिए। इस आधार पर रदरफोर्ड ने यह माना कि परमाणु का सम्पूर्ण धन-आवेश एक सूक्ष्म स्थान में केन्द्रित रहता है (यह परमाणु में समान रूप से वितरित नहीं हो सकता जैसा कि टॉमसन ने माना था)।
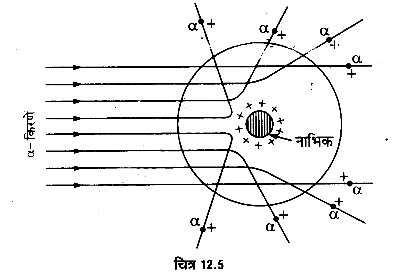
- कुछ α-कण ऐसे भी हैं जो अपने प्रारम्भिक मार्ग से 90° से भी अधिक कोण पर प्रकीर्णित होकर वापस लौट आते हैं (चित्र 12.5)। इससे यह पता चलता है कि जब धनावेशित α-कण स्वर्ण-पत्र के परमाणुओं में से गुजरते हैं, तो किसी-किसी कण पर इतना अधिक प्रतिकर्षण-बल लगता है। कि वह तीव्रगामी α-कण को वापस लौटा देता है। इस आधार पर रदरफोर्ड ने यह माना कि धन-ऑवेश परमाणु के भीतर एक अत्यन्त सूक्ष्म स्थान में संकेन्द्रित रहता है। इस स्थान को ‘नाभिक’ (nucleus) कहते हैं। गणना करने पर नाभिक की त्रिज्या 10-15 मीटर की कोटि की पायी जाती है, जबकि परमाणु की त्रिज्या 10-10 मीटर की कोटि की है। अत: नाभिक की त्रिज्या परमाणु की त्रिज्या के दस हजारवें भाग के बराबर होती है। परमाणु के शेष खाली भाग में केवल इलेक्ट्रॉन होते हैं। α-कण नाभिक के जितना पास आयेगा, उस पर उतना ही अधिक प्रतिकर्षण-बल लगेगा और वह उतना ही अधिक विक्षेपित होगी। यदि परमाणु के आकार की तुलना में नाभिक अत्यन्त छोटा है, तो किसी ४-कण की नाभिक के समीप पहुँचने की सम्भावना भी बहुत कम होगी। अतः अधिक कोणों पर प्रकीर्णित होने वाले α-कणों की संख्या कम होगी। प्रयोग से इस तथ्य की पुष्टि होती है। गणना द्वारा देखा गया है कि लगभग 20,000 में से केवल 1 ही α-कण ऐसा है जो कि 90° से अधिक कोण पर प्रकीर्णित होता है। इस प्रकार, इस प्रयोग द्वारा परमाणु के धन-आवेश के विस्तार के सम्बन्ध में महत्त्वपूर्ण जानकारी प्राप्त हुई।
- α-कणों के प्रकीर्णन के प्रयोग द्वारा कूलॉम नियमे की सत्यता के सम्बन्ध में भी जानकारी प्राप्त हुई। रदरफोर्ड ने यह माना था कि जब कोई α-कण स्वर्ण-पत्र के परमाणुओं में से गुजरता है, तो उस पर नाभिक द्वारा लगाया गया प्रतिकर्षण-बल कूलॉम के नियमानुसार (कण की नाभिक से दूरी के वर्ग के व्युत्क्रमानुपाती) होता है। जो कण परमाणु से गुजरते समय नाभिक से दूर रहता है। उस पर लगने वाला प्रतिकर्षण-बल इतना कम होता है कि वह बिना किसी विशेष विक्षेप के अपने मार्ग पर चला जाता है। परन्तु जो कण नाभिक के जितना समीप से गुजरता है उस पर उतना ही अधिक प्रतिकर्षण-बल लगता है तथा वह उतने ही बड़े कोण से प्रकीर्णित होता है। रदरफोर्ड ने, कूलॉम के नियम के आधार पर विभिन्न कोण पर प्रकीर्णित होने वाले कणों का परिकलन किया। और यह पाया कि नाभिकं द्वारा α-कणों का प्रकीर्णन कूलॉम नियम के अनुसार होता है। दूसरे शब्दों में, कूलॉम का नियम परमाणवीय दूरियों के लिये भी लागू रहता है।
- रदरफोर्ड ने अपने प्रयोग द्वारा विभिन्न धातुओं के नाभिकों के धन-आवेशों के सम्बन्ध में भी जानकारी प्राप्त की। उसने -कणों को विभिन्न धातुओं (जैसे–सोना, चाँदी, प्लैटिनम इत्यादि) के पतले पत्रों पर गिराकर एक निश्चित दिशा में प्रकीर्णित होने वाले कणों को गिना और देखा कि यह संख्या विभिन्न धातुओं के पत्रों के लिए भिन्न-भिन्न आती है। इससे यह पता चला कि विभिन्न धातुओं के नाभिकों में धन-आवेश का परिमाण भिन्न-भिन्न होता है। नाभिक में धन-आवेश जितना अधिक होगा, वह α-कण को उतने ही अधिक बल से प्रतिकर्षित करेगा तथा ।
α-कण अपने मार्ग से उतना ही अधिक प्रकीणित होगा। रदरफोर्ड ने गणना द्वारा यह दिखाया कि एक दिये हुए धातु-पत्र द्वारा एक निश्चित कोण-परिसर (range of angles) के भीतर प्रकीर्णित होने वाले -कणों की संख्या उस धातु के नाभिक के धन-आवेश की मात्रा के अनुक्रमानुपाती है। इस आधार पर सन् 1920 में चैडविक ने अनेक धातुओं के नाभिकों के धन-आवेशों को ज्ञात किया तथा यह पाया कि किसी धातु के नाभिक के धन-आवेश का परिमाण Ze होता है, जहाँ है इलेक्ट्रॉन के (ऋण) आवेश का मान है तथा Z उस धातु के लिये नियतांक है। Z को ‘परमाणु-क्रमांक’ (atomic number) कहते हैं।
रदरफोर्ड के परमाणु मॉडल में कमियाँ: रदरफोर्ड के परमाणु मॉडल में निम्न दो कमियाँ पायी गयीं
(i) परमाणु के स्थायित्व के सम्बन्ध में:
नाभिक के चारों ओर घूमते इलेक्ट्रॉन में अभिकेन्द्र त्वरण होता है। विद्युत गतिविज्ञान (electrodynamics) के अनुसार, त्वरित आवेशित कण ऊर्जा (विद्युत-चुम्बकीय तरंगें) उत्सर्जित करता है। अतः नाभिक के चारों ओर विभिन्न कक्षाओं में घूमते इलेक्ट्रॉनों से विद्युतचुम्बकीय तरंगें लगातार उत्सर्जित होनी चाहिए। इस प्रकार, इलेक्ट्रॉनों की ऊर्जा का ह्रास होने के कारण उनके वृत्तीय पथ की त्रिज्या लगातार कम होती जानी चाहिए और अन्त में वे नाभिक में गिर जाने चाहिए। इस प्रकार परमाणु स्थायी ही नहीं रह सकता।
(ii) रेखीय स्पेक्ट्रम की व्याख्या के सम्बन्ध में:
मॉडल में इलेक्ट्रॉनों के वृत्तीय पथ की त्रिज्या के लगातार बदलते रहने से उनके घूमने की आवृत्ति भी बदलती रहेगी। इसके फलस्वरूप इलेक्ट्रॉन सभी आवृत्तियों की विद्युत-चुम्बकीय तरंगें उत्सर्जित करेंगे, अर्थात् इन तरंगों का स्पेक्ट्रम संतत (continuous) होगा। परन्तु वास्तव में परमाणुओं के स्पेक्ट्रम संतत न होकर, रेखीय होते हैं अर्थात् उनमें बहुत-सी बारीक रेखाएँ होती हैं तथा प्रत्येक स्पेक्ट्रमी रेखा की एक निश्चित आवृत्ति होती है। अत: परमाणु से केवल कुछ निश्चित आवृत्ति की ही तरंगें उत्सर्जित होनी चाहिए, सभी आवृत्तियों की नहीं। इस प्रकार, रदरफोर्ड मॉडल रेखीय स्पेक्ट्रम की व्याख्या करने में असक्षम रहा। इन कमियों को नील बोर ने क्वाण्टम सिद्धान्त के आधार पर दूर किया।
प्रश्न 2:
हाइड्रोजन परमाणु के लिए एक ऊर्जा-स्तर आरेख बनाइए तथा (i) लाइमन श्रेणी एवं (ii) बॉमर श्रेणी के संगत संक्रमण दिखाइए। ये श्रेणियाँ स्पेक्ट्रम के किस क्षेत्र में आती हैं? (2011)
या
हाइड्रोजन परमाणु के लिए ऊर्जा-स्तर आरेख खींचिए तथा स्पेक्ट्रमी रेखाओं की लाइमन, बॉमर तथा पाश्चन श्रेणियों की उत्पत्ति समझाइए। इन श्रेणियों में से कौन-सी स्पेक्ट्रम के दंश्य भाग में मिलती है? (2015, 17)
या
ऊर्जा स्तर की सहायता से हाइड्रोजन परमाणु में बॉमर श्रेणी का बनना समझाइए। इस श्रेणी की रेखाएँ विद्युत-चुम्बकीय स्पेक्ट्रम के किस भाग में पड़ती हैं? (2014)
या
हाइड्रोजन स्पेक्ट्रम की विभिन्न श्रेणियों के लिए तरंगदैर्घ्य का सूत्र लिखिए। हाइड्रोजन – परमाणु की लाइमन श्रेणी की प्रथम रेखा की तरंगदै ज्ञात कीजिए। इस श्रेणी की सीमा
तरंगदैर्घ्य भी ज्ञात कीजिए। [R= 1.097 x 107 मी-1 ] (2012)
या
एक ऊर्जा स्तर आरेख खींचकर परमाणु के उत्सर्जन स्पेक्ट्रम की लाइमन तथा बॉमर श्रेणियाँ प्रदर्शित कीजिए। (2013)
या
एक स्पष्ट ऊर्जा-स्तर आरेख खींचकर हाइड्रोजन परमाणु की लाइमन तथा बॉमर स्पेक्ट्रम श्रेणियाँ प्रदर्शित कीजिए। ये श्रेणियाँ किस क्षेत्र में आती हैं? (2013)
या
बॉमर श्रेणी के स्पेक्ट्रमी रेखाओं की उत्पत्ति ऊर्जा-स्तर आरेख की सहायता से समझाइए। (2014)
या
हाइड्रोजन परमाणु की n वीं कक्षा में इलेक्ट्रॉन की ऊर्जा En = इलेक्ट्रॉन वोल्ट (eV) सूत्र से दी जाती है। इसके आधार पर
(i) n = 1, 2, 3, 4, 5, 6 तथा ∞ के लिए विभिन्न ऊर्जा स्तरों की खींचिए।
(ii) विभिन्न इलेक्ट्रॉनिक संक्रमणों द्वारा हाइड्रोजन परमाणु के उत्सर्जन स्पेक्ट्रम की लाइमन तथा बॉमर श्रेणियों को प्रदर्शित कीजिए। (2015, 17)
या
हाइड्रोजन उत्सर्जन स्पेक्ट्रम में लाइमन श्रेणी का बनना, ऊर्जा स्तर आरेख के आधार पर समझाइए। लाइमन श्रेणी की प्रथम रेखा की तरंगदैर्घ्य की गणना कीजिए। (2015)
या
हाइड्रोजन परमाणु में ऊर्जा स्तरों की En = eV से व्यक्त किया जाता है। ऊर्जा-स्तर आरेख खींचकर Hα तथा Gγ संक्रमणों को दर्शाइए तथा उनकी तरंगदैर्घ्य भी ज्ञात कीजिए। (2018)
उत्तर:
बोर ने अपने परमाणु मॉडल द्वारा हाइड्रोजन के विभिन्न ऊर्जा-स्तरों की ऊर्जाओं के लिए निम्नलिखित सूत्र प्राप्त किया

इसमें पूर्णांक n क्वाण्टम संख्या है, R रिडबर्ग नियतांक, h प्लांक नियतांक तथा c प्रकाश की चाल है।
माना हाइड्रोजंग परमाणु के दो ऊर्जा-स्तर n1 व n2 हैं जिनकी संगत ऊर्जाएँ क्रमशः E1 व E2 हैं। यदि ऊर्जा-स्तर E2 से E1 पर संक्रमण द्वारा उत्सर्जित विकिरण की आवृत्ति ν हो, तो
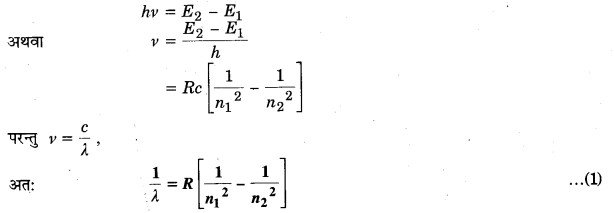
उपर्युक्त समीकरण द्वारा हाइड्रोजन के स्पेक्ट्रम में प्राप्त होने वाली सभी श्रेणियों की व्याख्या की जा सकती
1. लाइमन श्रेणी (Lyman Series):
इन रेखाओं को सबसे पहले लाइमन ने सन् 1916 में प्राप्त किया। जब किसी परमाणु में इलेक्ट्रॉन किसी ऊर्जा-स्तर से प्रथम (निम्नतम) ऊर्जा-स्तर में संक्रमण करता है (अर्थात् n1 = 1 तथा n2 = 2, 3, 4,…,∞) तब उत्सर्जित स्पेक्ट्रम की रेखाएँ पराबैंगनी भाग (ultraviolet part) में प्राप्त होती हैं। इनकी तरंगदैर्घ्य निम्नलिखित सूत्र से व्यक्त की जा सकती है

इसकी सबसे बड़ी तरंगदैर्ध्य अथवा प्रथम रेखा की तरंगदैर्ध्य n = 2 के लिए प्राप्त होती है जिसका मान 1216Å तथा सबसे छोटी, तरंगदैर्घ्य n = 2 के लिए 912Å (श्रेणी-सीमा) प्राप्त होती है।
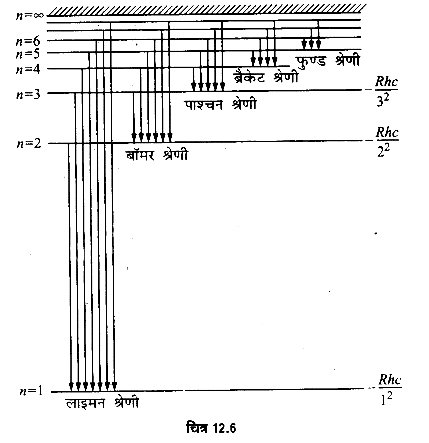
2. बॉमर श्रेणी (Balmer Series):
इन रेखाओं को सबसे पहले बॉमर ने सन् 1885 में प्राप्त किया। जब परमाणु किसी ऊँचे ऊर्जा-स्तर से दूसरे ऊर्जा-स्तर में संक्रमण करता है (अर्थात् n1 = 2 तथा n2 = 3, 4, 5, …) तो उत्सर्जित स्पेक्ट्रम की रेखाएँ दृश्य भाग (visible part) में मिलती हैं। इनकी तरंगदैर्ध्य को निम्नलिखित सूत्र से व्यक्त किया जा सकता है।

n = 3 के लिए सबसे बड़ी तरंगदैर्घ्य 6563Å तथा n = ० के लिए इस श्रेणी की सबसे छोटी तरंगदैर्घ्य 3646 Å प्राप्त होती है। n = 3, 4, 5, 6, … के संगत प्राप्त रेखाओं को क्रमशः Hα, Hβ, Hγ, Hδ,…. रेखाएँ भी कहते हैं। बॉमर श्रेणी की प्रथम रेखा के लिए n = 3; अतः उपर्युक्त सूत्र में R = 1.097 x 107 मी-1 रखकर सरल करने पर
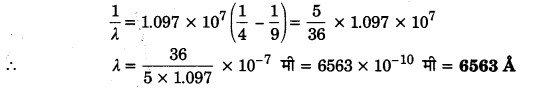
3. पाश्चन श्रेणी (Paschen Series):
जब किसी परमाणु में इलेक्ट्रॉन किसी उच्च ऊर्जा-स्तर से तीसरे ऊर्जा-स्तर में संक्रमण करता है, अर्थात् (n1 = 3 तथा n2 = 4, 5, 6,…) तो उत्सर्जित रेखाएँ स्पेक्ट्रम के अवरक्त (infrared) भाग में प्राप्त होती हैं। इनकी तरंगदै निम्नलिखित सूत्र से व्यक्त की जाती है।

4. ब्रैकेट श्रेणी (Bracket Series):
जब किसी परमाणु में इलेक्ट्रॉन किसी ऊँचे ऊर्जा-स्तर से चौथे ऊर्जा-स्तर में आता है (n1 = 4 तथा n2 = 5, 6, 7, …..) तो ये रेखाएँ भी स्पेक्ट्रम के अवरक्त भाग में प्राप्त होती हैं। इसकी तरंगदैर्घ्य निम्नलिखित सूत्र से व्यक्त की जाती है।

5. फुण्ड श्रेणी (Pfund Series):
जब किसी परमाणु में इलेक्ट्रॉन किसी ऊँचे ऊर्जा-स्तर से पाँचवें ऊर्जा-स्तर में आता है (n1 = 5 तथा n2 = 6, 7, 8, …..) तो ये रेखाएँ भी स्पेक्ट्रम के अवरक्त भाग में प्राप्त होती हैं। इसकी तरंगदैर्घ्य निम्नलिखित सूत्र से व्यक्त की जाती है।

प्रश्न 3:
हाइड्रोजन परमाणु का आयनन विभव 13.6 वोल्ट है। ज्ञात कीजिए
(i) रिडबर्ग नियतांक,
(ii) बॉमर श्रेणी की H लाइन की तरंगदैर्घ्य तथा (2012)
(iii) लाइमन श्रेणी की सबसे छोटी तरंगदैर्घ्य। (2011)
हल:
(i) ∵ हाइड्रोजन परमाणु का आयनन विभव = 13.6 वोल्ट; अतः आयनन ऊर्जा = 13.6 eV
∴ nवें ऊर्जा-स्तर की ऊर्जा En= – (13.6/n) eV
सूत्र En = – Rhc/n2 से,
E1 = – Rhc/12 = – Rhc तथा E∞ = 0
∴ आयनन ऊर्जा = E∞ – E1 = 0- (- Rhc) = Rhc

प्रश्न 4:
एक हाइड्रोजन परमाणु दो लगातार संक्रमणों के द्वारा ऊर्जा अवस्थाn = 6 से निम्नतम ऊर्जा अवस्था में आता है। प्रथम संक्रमण में उत्सर्जित फोटॉन की ऊर्जा 1.13 eV है। ज्ञात कीजिए
(i) प्रथम संक्रमण के पश्चात् परमाणु जिस ऊर्जा अवस्था में आता है, उसके लिए nका मान।
(ii) द्वितीय संक्रमण में उत्सर्जित फोटॉन की ऊर्जा। हाइड्रोजन परमाणु की आयनन ऊर्जा = 13.6 eV है। (2012)
हल:
(i) हाइड्रोजन परमाणु की n वीं ऊर्जा-अवस्था में ऊर्जा

प्रश्न 5:
हाइड्रोजन परमाणु की निम्नतम स्तर की ऊर्जा -13.6eV है।
(i) द्वितीय उत्तेजित अवस्था में किसी इलेक्ट्रॉन की गतिज ऊर्जा क्या है?
(ii) यदि इलेक्ट्रॉन द्वितीय उत्तेजित अवस्था से प्रथम उत्तेजित अवस्था में कूदता है तो स्पेक्ट्रमी रेखा की तरंगदैर्घ्य ज्ञात कीजिए।
(iii) परमाणु को आयनित करने के लिए आवश्यक ऊर्जा की गणना कीजिए। (2017)
हल:

(iii) यदि आयनन ऊर्जा ∆E है तो आयनन के बाद परमाणु की ऊर्जा
= आयनन ऊर्जा + आयनन से पूर्व ऊर्जा
अथवा 0 = ∆E – 13.6eV (∵ आयनेने के बाद ऊर्जा E∞ = 0)
अतः आयनन ऊर्जा ∆E = 13.6 eV
We hope the UP Board Solutions for Class 12 Physics Chapter 12 Atoms (परमाणु) help you.